未來免疫細胞的用途越來越廣,健康的免疫細胞是培養擴增的必須條件,因此來源上不斷擴寬,不局限于外周血,臍帶血中同樣含有豐富的免疫細胞。
免疫細胞治療技術發展日新月異,如CAR-T等,有望給腫瘤治療帶來全新的變革。但是,免疫細胞治療技術需要一個基礎——健康的免疫細胞。然而,在治療過程中,部分患者外周血幾乎全是腫瘤細胞,一些久病體虛和經不起反復采血的老年患者,無法從外周血採集到足夠數量的健康免疫細胞。 臍帶血是不錯的免疫細胞來源。臍帶血不僅富含造血幹細胞、間充質幹細胞,還含有豐富的免疫細胞,如T細胞、NK細胞、樹突狀細胞等。臍帶血中的免疫細胞既具有高度的多樣性,也有極強的擴增能力。因此,臍帶血可以作為提取 T 細胞、NK 細胞、樹突狀細胞的資源平臺,用於體外擴增或基因修飾,從而改善細胞免疫療法。
臍帶血CIK細胞增殖速度更快
臍帶血的T細胞與外周血不同,具有更強的抗腫瘤作用、更弱的移植物抗宿主病(GVHD)作用。這主要得益於臍帶血T細胞的活化差異,即腫瘤部位高活化,其他部位低活化。外周血來源的CIK以誘導腫瘤細胞的凋亡為主;而臍帶血來源的CIK則以誘導腫瘤細胞壞死為主。此外,臍帶血來源的CIK相對來說,免疫原性較弱、增殖速度更快、存活時間更長、回輸後移植物抗宿主病(GVHD)發生率更低等特點。

採用流式細胞術對比觀察來自外周血和臍帶血的CIK的表型特徵及其與抗腫瘤活性的關係,發現兩種不同來源的CIK生物學活性存在較大差異,臍帶血來源的CIK體外誘導培養13天后具有較低的免疫原性和較高的增殖率,其中含抗腫瘤活性的CD3+CD56+細胞的百分率較高。裸鼠異種移植模型試驗顯示,臍帶血來源的CIK能顯著抑制體內腫瘤細胞的生長,具有明顯的殺瘤活性,說明無論是體內試驗還是體外試驗,臍帶血來源的CIK均較外周血來源的CIK具有更高的抗腫瘤活性。
臍帶血CIK細胞治療,客觀緩解率提升1倍
通過回顧性的臨床試驗觀察15例接受臍帶血來源CIK治療惡性腫瘤的療效、安全性及體外殺傷活性,結果顯示輸注臍帶血來源CIK後,患者外周血中CD3+ CD4+T細胞和CD3- CD56+T細胞比例明顯增加。令人振奮的是,其中1例肝癌和食管癌患者達到完全緩解,2例卵巢癌患者獲得部分緩解,10例病情穩定,這說明臍帶血來源CIK是一種治療多種惡性腫瘤的安全有效方法,特別適宜一些久病體虛和不能承受反復采血的老年患者。 一項發表在國際期刊《Int Immunopharmacol》的臨床研究顯示,臍帶血來源CIK細胞聯合二線化療治療晚期實體瘤,顯著改善一線化療失敗的晚期實體瘤患者的生存期。研究將40例一線化療失敗後晚期實體瘤患者分為臍帶血來源CIK細胞+二線化療組和二線單獨化療組。

結果顯示,臍帶血CIK+二線化療組的客觀緩解率(ORR)和疾病控制率(DCR)分別為30%和80%;而化療組的ORR和DCR分別為15%和70%,客觀緩解率提升了一倍。臍帶血CIK+二線化療組的無進展生存期(PFS)和總生存期(OS)分別為3.45個月和11.17個月,而化療組的PFS和OS分別為2.03個月和7.52個月。與單獨二線化療相比,臍帶血來源的CIK細胞聯合二線化療可顯著改善一線化療失敗後晚期實體瘤的無進展生存期和中位生存期。
NK細胞在臍帶血中更豐富
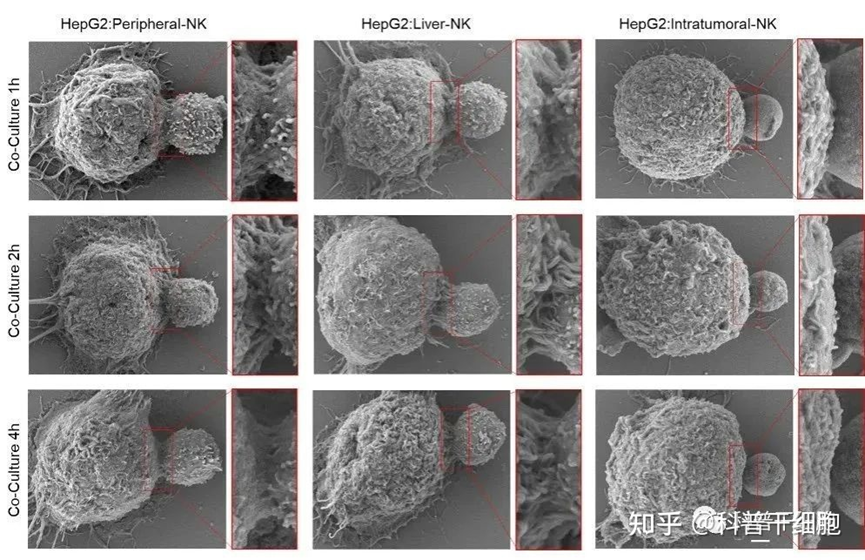
最新研究發現:相對外周血液和骨髓中,NK細胞和NK祖細胞在臍帶血中最為豐富。臍帶血來源NK細胞易採集、免疫原性低、組織相容性好、細胞較原始狀態,增殖能力更強,靶向殺傷癌細胞的效率更高;此外,細胞收集和冷凍保存更加便捷,細胞活力和殺傷活性不受影響。 McMaster大學的研究人員發現,經過體外擴增的NK細胞可以用於乳腺癌治療,同時,從長期深低溫保存的NK細胞並不影響它的擴增能力和抗腫瘤活性,該項成果發表於 《Journal of immunotherapy》。

研究人員從臍帶血中分離並體外擴增了大量啟動的NK細胞,然後對這些NK細胞殺傷乳腺癌細胞的作用進行了觀察,根據凍存時間長短,將臍帶血分為三個組別:長期組(深低溫凍存1-10年)、短期組(深低溫凍存小於1年)、未凍存組(未經凍存的臍帶血)。實驗結果顯示:長期冷凍保存對臍帶血NK細胞的擴增潛能和抗腫瘤活性都沒有影響。同時,這些細胞在攻擊原發性乳腺癌細胞時特別有效。
臍帶血來源NK細胞治療,79%患者客觀緩解
2017年,美國加州大學三藩市分校研究團隊開展了一項體外擴增臍帶血來源的 NK細胞治療多發性骨髓瘤的臨床試驗。在I期臨床試驗中,10名患者獲得了非常好的部分緩解,其中8名患者接近完全緩解或更好。在II期臨床試驗中,79%患者獲得了完全緩解或很好的部分緩解,3年無進展生存率可達 52%。

另外,在2018年,《Human Gene Therapy》刊登過一篇文章,研究發現,擴增後的臍帶血NK細胞具有較強的體內外抗腫瘤活性,可單獨應用或聯合貝伐單抗用於中晚期結直腸癌的治療。

近年來,隨著嵌合抗原受體(CAR)技術在CAR-T治療中的大顯身手,基於NK細胞的CAR-NK研究也方興未艾。CAR-NK具備顯著的抗腫瘤活性,安全性更高,還可批量生產,應用前景廣闊。 2020年2月,頂級醫學雜誌《新英格蘭醫學雜誌》發表了一項臍帶血來源的嵌合抗原受體NK細胞(CAR-NK)治療CD19陽性淋巴樣腫瘤的1/2期臨床研究。共納入11名復發或難治性CD19陽性癌症(非霍奇金淋巴瘤或慢性淋巴細胞白血病[CLL]),使用來自臍帶血的HLA不匹配的抗CD19 CAR-NK細胞。
研究結果顯示,在接受治療的11名患者中,8名(73%)有反應;在這些患者中,7例(4例淋巴瘤和3例CLL)完全緩解。輸注的CAR-NK細胞擴增並在低水準下持續至少12個月。CAR-NK細胞的給藥,沒有產生重大毒性作用。
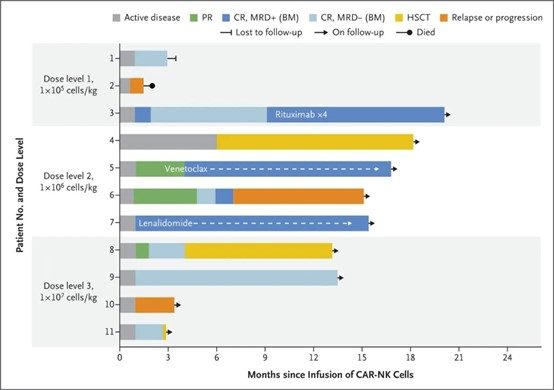
11名患者腫瘤治療情況
總結
腫瘤免疫細胞治療正迅速發展,CAR-T、TIL、TCR-T等細胞療法不斷湧現,NK、CIK、DC-CIK療法也在不斷優化反覆運算。未來免疫細胞的用途越來越廣,健康的免疫細胞是培養擴增的必須條件,因此來源上不斷擴寬,不局限于外周血,臍帶血中同樣含有豐富的免疫細胞。 臍帶血來源的免疫細胞為一些無法從外周血上獲取免疫細胞的患者提供了一個選擇。總之,在免疫細胞治療技術加速發展的時代,臍帶血的臨床價值和科研價值也在不斷水漲船高,為腫瘤患者和癌症高風險人群帶來福音。
參考文獻:
1.Cord blood-derived cytokine-induced killer cells biotherapy combined with second-line chemotherapy in the treatment of advanced solid malignancies.Int Immunopharmacol. 2011 2.Phase I study of cord blood-derived natural killer cells combined with autologous stem cell transplantation in multiple myeloma.Br J Haematol. 2017 3.Umbilical Cord Blood-Derived Natural Killer Cells Combined with Bevacizumab for Colorectal Cancer Treatment.Hum Gene Ther. 2019 4.Use of CAR-Transduced Natural Killer Cells in CD19-Positive Lymphoid Tumors.N Engl J Med. 2020