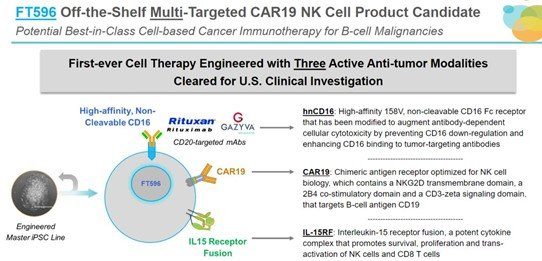
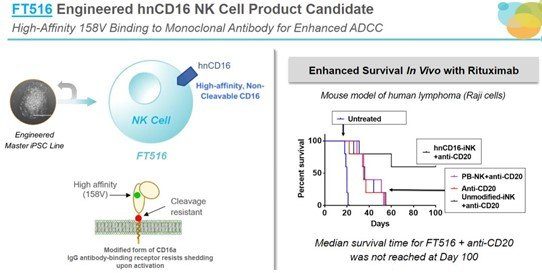
骨關節炎患者有望迎來全新的幹細胞治
2021年多家媒體報導,又一款針對膝骨關節炎的臍帶間充質幹細胞新藥研發(IND)申請獲得受理,再次展示了間充質幹細胞在骨關節炎領域的臨床應用前景。近年來,國際上陸續有治療骨關節炎的幹細胞新藥獲批上市,早在2009年,歐洲便審批上市了一款名為Chondrocelect的幹細胞藥物,用於膝關節軟骨缺損的治療;2012年,韓國又有一款間充質幹細胞藥物Cartistem獲批用於治療退行性關節炎和膝關節軟骨損傷;2016年,幹細胞藥物Maci在美國獲批上市,用於治療膝關節軟骨損傷……這些臨床應用及發展,標誌著幹細胞療法在骨關節炎治療領域日趨成熟。
幹細胞如何逆轉骨關節炎?
骨關節炎(OA)常被稱為“致殘性關節炎”,是常見的老年人退行性疾病,近年來,其在年輕人群中的發病率也逐漸上升。目前尚無有效治療手段,臨床主要以對症治療,緩解症狀為主,最終可能需要進行關節置換手術。隨著科學的發展,幹細胞憑藉其直接分化,免疫調節,抗炎等特性在骨關節炎治療領域佔據一席之地。
間充質幹細胞能分化為骨和軟骨細胞,填補細胞缺損。目前,已經探索了幾種體外技術來幫助間充質幹細胞沿著軟骨形成的途徑分化,如轉化生長因數β1和胰島素樣生長因數1具有協同刺激幹細胞形成軟骨的作用[1]。發表于《國際分子科學雜誌》的一篇文章[2]表明,骨關節炎幹細胞注射治療後發生軟骨再生。該研究對顳下頜關節骨關節炎小鼠模型進行關節腔內注射間充質幹細胞,結果顯示動物模型小鼠的軟骨厚度顯著增加。
間充質幹細胞還可抑制炎性T細胞增殖,抑制單核細胞和髓系樹突狀細胞的成熟,具有免疫調節和抗炎作用。這種免疫調節機制提高了它們在自身免疫介導的炎性疾病(包括炎性關節病)中的應用潛力。除了免疫調節和分化潛能外,間充質幹細胞還表達重要的細胞因數,包括轉化生長因數β(轉化生長因數β)、血管內皮生長因數(VEGF)、表皮生長因數(EGF)和一系列刺激局部組織修復的生物活性分子[3]。這些營養因數,以及間充質幹細胞和軟骨細胞之間的直接細胞接觸,已經被觀察到影響軟骨分化和軟骨基質的形成。
近年來有研究發現[4],間充質幹細胞能夠使軟骨沉積增加,主要是因為間充質幹細胞在刺激軟骨細胞增殖和基質沉積方面的營養作用,其中免疫調節和旁分泌效應所發揮的作用更大,而不是基於間充質幹細胞直接分化成軟骨細胞所致。
幹細胞通過多種途徑來治療膝骨關節炎
截至目前,在美國國立衛生研究院的最大臨床試驗註冊庫http://clinicaltrials.gov網站上註冊的有關幹細胞治療骨關節炎的臨床研究項目達到了155項之多。目前有關幹細胞再生醫學在骨關節炎中的應用主要涉及以下三個方面。
1.操縱內源性幹細胞以幫助軟骨修復
前期研究發現,使用可以操縱內源性幹細胞的植入物來為骨關節炎提供再生治療。科研人員以前期工作為基礎[5],展示了通過植入支架來引導內源性幹細胞的歸巢和分化,從而實現關節再生。目前有待進一步探究的是,確定哪些候選幹細胞類型最具趨化性,以及加入額外的趨化因數是否會增強幹細胞對支架的滲透。
2.關節腔內注射幹細胞以幫助軟骨修復
將幹細胞直接注射到關節腔內,可以有效抑制骨關節患者的關節破壞以及實現關節軟骨的再生。根據關節腔內注射幹細胞治療骨關節炎的初步臨床試驗資料,這種方法在改善功能方面顯示了令人鼓舞的早期結果。國外學者開展的一項I期臨床試驗對13名膝關節骨性關節炎Ⅱ、Ⅲ期患者關節腔內間隔1個月注射兩劑間充質幹細胞,對每個患者進行至少24個月的隨訪,觀察是否有任何不良事件發生以及療效。結果顯示,關節腔內注射間充質幹細胞治療膝關節骨關節病是安全的,顯著改善了Koos評分和膝關節軟骨厚度[6]。對於關節腔內腔內注射幹細胞,未來的工作將需要繼續提高間充質幹細胞在軟骨表面的特異性靶向性和保留性,以便最大限度地發揮潛在作用。
3.幹細胞外泌體幫助軟骨修復
近年來,幹細胞來源的外泌體作為一種非細胞治療方法,因其強大生物學活性而備受關注。外泌體也可能是骨關節炎的一種新的治療選擇。針對骨關節炎動物模型中的研究表明,幹細胞來源的外泌體顯示出與完整幹細胞相似的生物學功能,在體外和體內均能減緩骨關節炎的進展[7]。然而,在應用於臨床之前,需要對其機制進行進一步的研究。
未來:全球更多的骨關節炎患者將受益
骨關節炎是一種退行性和進行性的疾病。隨著人口老齡化,它仍將是疼痛和殘疾的重要原因。目前的治療手段都旨在控制疾病的症狀,而無法延緩疾病進展,也無法逆轉該疾病。在一些臨床前和臨床試驗中,關節腔內注射間充質幹細胞可導致疼痛減輕和功能改善,此外注射間充質幹細胞後軟骨再生,這表明間充質幹細胞不僅可以延緩疾病進展,甚至可以逆轉疾病,有望治癒骨關節炎。
近年來,間充質幹細胞在骨關節炎的治療中提供了令人興奮的可能性。未來,還需要開展進一步的隨機對照試驗,從而為其走向臨床提供更多的佐證。相信不久的將來,全球更多的骨關節炎患者將能夠受益於幹細胞新藥。
參考文獻:
[1] Zhou S, Eid K, Glowacki J. Cooperation between TGF-beta and Wnt pathways during chondrocyte and adipocyte differentiation of human marrow stromal cells. J Bone Miner Res. 2004 Mar;19(3):463-70.
https://pubmed.ncbi.nlm.nih.gov/15040835/
[2] Köhnke R, Ahlers MO, Birkelbach MA, Ewald F, Krueger M, Fiedler I, Busse B, Heiland M, Vollkommer T, Gosau M, Smeets R, Rutkowski R. Temporomandibular Joint Osteoarthritis: Regenerative Treatment by a Stem Cell Containing Advanced Therapy Medicinal Product (ATMP)-An In Vivo Animal Trial. Int J Mol Sci. 2021 Jan 5;22(1):443.
https://pubmed.ncbi.nlm.nih.gov/33466246/
[3] Caplan AI, Correa D. The MSC: an injury drugstore. Cell Stem Cell. 2011 Jul