多年來,許多先進的醫學技術已經成為現實。醫學領域的持續發展挽救了數百萬人的生命並改善了許多人的生活。隨著歲月的流逝和技術的不斷改進,接下來將會有什麼進展?基因治療,醫學人工智慧,機器人手術,精准醫學,3D列印等是未來的重點發展領域,以下是美國克利夫蘭診所評選出 2019 年醫療革新技術和藥物。下面我將為大家介紹一下 克利夫蘭診所評選出 2019 年醫療革新技術和藥物。
美國克利夫蘭診所是美國最好的醫院之一,每年由它評選出“未來一年 十大世界突破醫療革新技術”的排行榜已經成為醫療界的風向標。
下面我將為大家介紹一下 克利夫蘭診所評選出 2019 年醫療革新技術和藥物。
TOP 10
基因治療
近年來,產業和分出公司對基因治療的興趣前所未有,這反映了對這一領域信心的增加。這些信心來源於基於治療效果的越來越多的報導和首批基因治療產品如EMA2012年批准的Glybera®(uniQure)和2016年治療ADA-SCID的SrimoSmithLe(葛蘭素史克)的上市。更近一些,諾華研發的首個CAR T細胞治療產品Kymriah(之前名為tisagenlecleucel-T 和CTL019)於2017年8月獲FDA批准。緊接著,由Kite Pharma研發的商品名為Yescarta的CAR-T治療產品和Spark Therapeutics 的Luxturna分別在10月和12月獲得FDA批准上市。學術界也獲得了越來越多的行業資助,進一步拓展了基因治療藥物的研發管線。

來源|銳景創意
TOP 9
經皮二尖瓣和三尖瓣置換術
一般認為,引起器質性三尖瓣關閉不全的原因很多,如風濕性心臟病、先天性Ebstein畸形、感染性心內膜炎所致的瓣膜毀損、三尖瓣脫垂、右心室心肌梗塞及胸部外傷等。
心臟是人體最任勞任怨、須臾不停的器官,瓣膜發生問題後仍要堅持工作,其結果往往是問題愈來愈嚴重,發展到晚期,換瓣毫無疑問是最可靠的治療手段,但是此時,往往患者的心肺功能已無法耐受心臟外科手術,很多患者不得不在藥物的維持下繼續低生活品質的生命歷程。
雖然目前心臟外科手術已經十分成熟,但心臟專科醫生們仍然在孜孜不倦地尋找減少創傷的治療技術,比如通過動脈在心臟置入支架。
近來,醫學家也在尋找更佳的心臟換瓣技術。2016 年經皮心臟二尖瓣和三尖瓣置換術已經成功實施,該技術通過皮下穿刺血管,將導管送至瓣膜處,對病灶進行手術置換。

來源|復旦大學附屬中山醫院心外科
TOP 8
機器人手術革新
在美國,手術機器人已經在臨床應用了十餘年,而且還在不斷地發展。運用機器人手術能提高精准度,減少感染的發生,縮短住院時間,減少手術創傷。
機器人手術用於微創手術,有助於提高精確度,控制力和靈活性。在手術機器人幫助下,外科醫生可以執行非常複雜的手術,否則這些手術非常困難或不可能執行。隨著技術的改進,它可以與增強現實相結合,以允許外科醫生在操作的同時即時查看患者的其他重要資訊。雖然手術機器人的發明引起了人們對機器人最終將取代人類外科醫生的擔憂,但它很可能僅用於協助和增強外科醫生的工作。

來源|視覺中國
TOP 7
高科技頭盔 用於院外中風患者診斷
加利福尼亞州的 Cerebrotech 醫療系統公司花了幾年時間開發出一款稱為 Cerebrotech Visor 的設備來檢測中風。該設備利用稱為體積阻抗相移光譜學(VIPS)的過程。這種設備被置於患者頭部,通過發射穿過大腦左右半球的低能量無線電波發揮作用。當這些無線電波通過大腦中的流體時,它們的頻率會改變。Visor評估這些頻率的變化,並比較大腦左右半球的資料。如果它們明顯不同,則表示發生了中風,差異越大,中風越嚴重。
在南卡羅來納州醫科大學最近進行的一項研究中,緊急醫療人員使用該設備評估懷疑患有中風的患者。對於每個患者,取三個讀數並取平均值。神經影像後來被用來提供明確的診斷。與那些診斷相比較,發現 Visor在確定哪些患者發生了重大中風時準確率為 92%。雖然這個準確率並不完美,但它比應急人員使用“標準身體檢查工具”獲得的準確率要高,據報導其範圍在40%至89%不等。

來源|視覺中國
TOP 6
虛擬實境VR眼鏡,將用於醫學教育
VR(虛擬實境技術)是一種可以創建和體驗虛擬世界的電腦模擬系統,它利用電腦生成一種類比環境,讓體驗者可以“親眼看到”動態的三維立體逼真圖像。
虛擬實境已發展一段時間了。最近,隨著醫學和技術的進步,醫學生已經能夠使用該技術接近現實的醫療體驗。先進的VR設備通過排練程式,提供對人體解剖結構如何連接的直觀理解,幫助他們獲得所需的體驗。該VR設備也將作為患者提供更大的幫助。事實證明,它在患者康復和康復方面非常有用。

來源|視覺中國
TOP 5
3D列印用於生產患者特殊需要的產品
如果您還沒有聽說過,3D印表機很快就會成為市場上最熱門的技術之一。這些印表機可用於創建植入物以及甚至在手術期間使用的關節。3D列印假肢越來越受歡迎,因為它們完全是定制的,數位化功能使它們能夠將個人的測量值與列印實物做到毫米級相匹配,提供前所未有的植入舒適度和移動便利性。
運用 3D 列印技術,使用特殊材料為患者量身製作專門的身體“零件”,如假肢、顱骨和骨科置入器械等,這樣做出來的“零件”能更好地被人體接受,減少排斥反應的發生,提高患者的舒適度,也能減少不必要的浪費。
使用印表機可以生產持久和可溶物品。例如,3D列印可用於“列印”含有多種藥物的藥丸,這將有助於患者組織定時和監測多種藥物。這是技術和醫學協同工作的真實例子。

來源|視覺中國
TOP 4
癌症免疫療法的進步
癌症免疫療法又稱為生物治療,是一種利用身體自身免疫系統來對抗癌症的技術。雖然癌症的免疫療法已經存在一段時間,但由於全世界致力於治癒癌症的研究層出不窮,所以不斷出現新的免疫治療靶點。
腫瘤免疫治療是指應用免疫學原理和方法,通過啟動體內的免疫細胞和增強機體抗腫瘤免疫應答,特異性地清除腫瘤微小殘留病灶、抑制腫瘤生長,打破免疫耐受的治療方法。腫瘤免疫治療就是要克服腫瘤免疫逃逸的機制,從而重新喚醒免疫細胞來清除癌細胞。由於其副作用小、治療效果明顯,正逐漸成為未來腫瘤治療的發展方向,被稱為繼手術、放療和化療之後的第四大腫瘤治療技術。

來源|視覺中國
TOP 3
延長急性腦卒中干預時間窗
急性腦卒中的干預時機尤為重要。卒中之後如果伴隨缺血,會對患者造成不可逆轉的傷害,通常會導致殘疾。在很多卒中案例中,可採取不同的干預方式,但是到目前為止,卒中的干預只有在一定時間窗內才被推薦。2017年發表的最新指南建議,延長卒中治療的時間窗,可以為更多卒中患者減少殘疾的風險,為患者康復提供機會。
但由於指南推薦的時間窗限制時間太短,導致很多患者錯過治療時機。所以 2017 年發表的最新指南建議,延長卒中治療的時間窗,為更多卒中患者減少殘疾的風險,為患者康復提供機會。

來源|視覺中國
TOP 2
醫療人工智慧的發展
當前,人工智慧在醫學領域的應用已從理論走向實踐。在醫療行業,AI在決策支援、影像分析和患者分診方面的應用,正在改變遊戲規則。現在的AI可幫助醫生在診療中做出更好的決策,讓他們可以更方便、更準確地分析患者掃描結果,還可減少過勞。例如,機器學習演算法就有能力指出影像中有問題的部位,甚至説明完善掃描過程,迅速從電子病歷系統,成山的資料中找出原因。隨著AI被整合進醫療,醫療服務將轉型為追求更智慧。
得益于醫學領域的海量臨床資料以及人工智慧技術的支援,醫療人工智慧發展迅速,涉及到智慧健康管理平臺、人工智慧虛擬助理、醫療影像輔助診斷、藥物研發等諸多應用。醫療人工智慧的發展將極大緩解醫療資源緊張的局面,調整醫療服務模式,減輕醫生負擔,提升服務效率。
AI 的目的不是替代醫生或者做出臨床決策,而是加強和完善機器的人性化,更好地與人交流。隨著 AI 與醫療結合,醫療服務將轉型為追求更智慧的方式。

來源|視覺中國
TOP 1
疼痛替代治療 對抗阿片類藥物危機
阿片類藥物危機已被宣佈成為公共健康危機。如今,慢性疼痛是阿片類藥物處方的來源,儘管針對慢性疼痛有一些臨床認可的替代治療,但是沒有一個療法能遏制這場危機。
現在藥物基因組學(pharmacogenomic)試驗帶來了希望,它可以通過分析患者基因的組成,預測個體藥物(包括阿片類藥物)的代謝情況。藥物基因組學測試可以用於避免副作用,消除不必要和無效的處方,用更有效的藥物來替代。
藥物基因組學也可用于預測使用阿片類鎮痛藥後,誰的疼痛不會緩解,及時更新此類患者的處方。此外,藥物基因組學可以減少或消除被強加給患者的“覓藥”恥辱感,給他們提供定制的用藥療法。2019年,隨著基因試驗的增多,藥物基因組學很有潛力成為精准治療的一大進步,並消除阿片類藥物危機。
2019 年隨著基因試驗的增多,藥物基因組學很有潛力成為精准治療的一大進步技術,並可以用於解除阿片類藥物危機。

來源|視覺中國
參考來源:
http://www.youtube.com/watch?v=yVIbfQFIPv0&t=2457s
MIS2018:”Top 10″Medical Innovations :2019


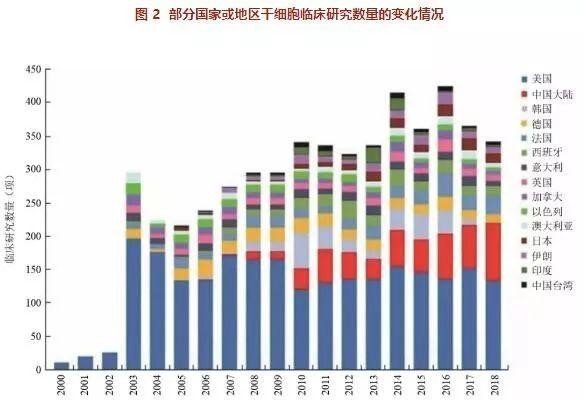
 資料來源:clinicaltrials.gov 和 ICTRP
資料來源:clinicaltrials.gov 和 ICTRP 資料來源:clinicaltrials.gov 和 ICTRP(截至 2019 年 2 月底)
資料來源:clinicaltrials.gov 和 ICTRP(截至 2019 年 2 月底)




















