
高危對象1.40歲以上有兩週肛腸症狀的人群;2.有大腸癌家族史的直系親屬;3.大腸腺瘤治療後的人群;4.長期患有潰瘍性結腸炎的患者;5.大腸癌手術後的人群;6.有家族性腺瘤性息肉病(FAP)和遺傳性非息肉病性結直腸癌(HNPCC)家族史的20歲以上直系親屬;7.45歲以上無症狀人群。注:兩週肛腸症狀指有以下任意症狀持續兩週以上:大便習慣改變(便秘、腹瀉等);大便形狀改變(大便變細);大便性質改變(便血、粘液便等);腹部固定部位疼痛。
篩查建議1.40歲以上有症狀高危對象,經兩週對症治療症狀沒有緩解者,應及時作肛門直腸指檢、大便隱血試驗(FOBT)檢查,任一指標陽性應進行腸鏡檢查,如FOBT陽性者經腸鏡檢查仍未示有異常,建議作胃鏡檢查,以排除上消化道出血。2.40歲以上無症狀高危對象,每年接受一次FOBT檢查,如隱血試驗陽性,則進一步腸鏡檢查以明確診斷。如FOBT檢查連續3次陰性者可適當延長篩查間隔,但不應超過3年。3.年齡大於20歲的FAP和HNPCC家族成員,當家族中先發病例基因突變明確時,建議行基因突變檢測,陽性者每1-2年進行1次腸鏡檢查。如基因突變檢測陰性,則按照40歲以上個體進行篩查。4.45-75歲無症狀篩檢對象,每年接受1次FOBT檢查,每10年接受1次腸鏡檢查。5.糞便或血液的多靶點基因檢測可能有助於篩查,糞便標本的證據更為充分,但由於價格較為昂貴,限制了其應用。
預防建議1.運動可有效減少腫瘤發生,堅持體育鍛煉,避免肥胖;2.健康膳食,增加粗纖維、新鮮水果攝入,避免高脂高蛋白飲食;3.非甾體類消炎鎮痛藥可能對預防腸癌有效,老年人可嘗試服用低劑量阿司匹林,可能減少心腦血管疾病和腸癌發生的風險,具體使用須諮詢醫生;4.戒菸,避免其對消化道的長期毒性和炎性刺激。

高危對象1.未生育,或≥35歲初產婦;2.月經初潮≤12歲,或行經≥42歲的婦女;3.一級親屬在50歲前患乳腺癌者;4.兩個以上一級或二級親屬在50歲以前患乳腺癌或卵巢癌者;5.對側乳腺癌史,或經乳腺活檢證實為重度非典型增生或乳管內乳頭狀瘤病者;6.胸部放射治療史(≥10年)者。注:一級親屬指父母、子女一級兄弟姐妹(同父母)二級親屬指叔、伯、姑、舅、姨、祖父母、外祖父母。上述情況均為乳腺癌高危因素,伴2條及以上因素時,應考慮為高危乳腺癌對象。
篩查建議1.一般婦女乳腺自查:20歲以後每月檢查一次;臨床體檢:20-29歲每三年一次,30歲以後每年一次;X線檢查:35歲,拍攝基礎乳腺片;隔年一次乳腺X線檢查(鉬靶);>40歲,每1~2年一次乳腺X線檢查,60歲以後可隔2~3年乳腺X線檢查1次。超聲檢查:30歲以後每年一次乳腺超聲檢查。2.乳腺癌高危人群鼓勵乳腺自查,20歲以後每年做臨床體檢1次,30歲以後建議乳腺核磁共振(MRI)檢查。
預防建議1.健康生活方式,遠離菸酒,合理營養,保持健康體重,堅持鍛煉。2.適時生育,母乳喂養。3.參加乳腺篩查,定期體檢。
高危對象1.有多個性伴侶2.性生活過早3.HPV感染4.免疫功能低下5.有宮頸病變史的女性
篩查建議已婚或有性生活史3年及以上的女性都建議進行篩查:1.21~29歲採用宮頸細胞學檢查,連續篩查3年無異常後,每3年1次;2.30~65歲採用宮頸細胞學檢查,連續篩查3年無異常後,每3年1次;或者高危型HPV與宮頸細胞學聯合篩查,連續篩查3年無異常後,每5年1次;3.篩查結束時間:>65歲且既往多次檢查均示陰性,則結束篩查;若曾診斷為高度鱗狀上皮內病變(HSIL)病史者,再持續篩查20年,篩查頻率視病情定;4.接受過子宮全切術的女性(無宮頸),且過去20年裡未曾有CIN2、CIN3、原位癌或癌症的女性,不需要檢查;5.接種過HPV疫苗的女性,遵循特定年齡的建議(與未接種疫苗的女性一樣)。
預防建議1.接種HPV疫苗;2.不吸煙或戒菸;3.安全與健康性行為;4.及時治療生殖道感染疾病;5.增強體質。

高危對象年齡>40歲,至少合併以下一項危險因素者:1.吸煙≥20年包,其中包括戒菸時間不足15年者;2.被動吸煙者;3.有職業暴露史(石棉、鈹、鈾、氡等接觸)者;4.有惡性腫瘤病史或肺癌家族史者;5.有慢性阻塞性肺疾病或瀰漫性肺纖維化病史者。注:年包:指每天吸煙多少包乘以持續多少年,例如20年包指每天1包持續20年或每天2包持續10年。
篩查建議1.對於肺癌高危人群,建議行LDCT篩查。建議盡可能使用32層或以上多層螺旋CT進行肺癌篩查。掃描範圍為肺尖至肋膈角尖端水平。基線CT掃描以後,根據病灶具體情況(形態、大小、邊界等特徵),建議至專科醫院諮詢具體下一步診療計劃;2.若檢出肺內結節,根據結節不同特徵,磨玻璃、亞實性、實性結節及多發結節的具體情況進行LDCT複查;3.根據國情和效能以及我國人群特徵,不推薦將PET/CT作為人群肺癌篩查的方法。注:LDCT:低劑量螺旋CT
預防建議1.不吸煙或戒菸;2.對於有職業最露危險的應做好防護措施;3.注意避免室內空氣污染,比如被動吸煙、明火燃煤取暖、接觸油煙等;4.大氣嚴重污染時,避免外出和鍛煉;5.有呼吸系統疾病者要及時規範地進行治療。

高危對象男性35歲以上、女性45歲以上的以下人群:1.感染乙型肝炎病毒(HBV)或丙型肝炎病毒(HCV)者;2.有肝癌家族史者;3.血吸蟲、酒精性肝硬化等任何原因引起的肝硬化患者;4.藥物性肝損患者。
篩查建議1.男性35歲以上、女性45歲以上的肝癌高危人群應進行篩查;2.聯合應用血清甲胎蛋白(AFP)和肝臟B超檢查,每6個月篩查一次。
預防建議1.接種乙肝疫苗;2.慢性肝炎患者儘早接受抗病毒治療以控制肝炎病毒的複制;3.戒酒或減少飲酒;4.清淡飲食,減少油膩食物攝入;5.避免發霉食物的攝入。

高危對象凡有下述情況之一者,均係高危對象:1.60歲以上人群;2.中重度萎縮性胃炎;3.慢性胃潰瘍;4.胃息肉;5.胃黏膜巨大皺褶徵;6.良性疾病術後殘胃(術後10年);7.胃癌術後殘胃(術後6~12月);8.幽門螺桿菌感染者;9.明確胃癌或食管癌家族史;10.惡性貧血者
篩查建議年齡>40歲有腹痛、腹脹、反酸、燒心等上腹部不適症狀,並有慢性胃炎、胃粘膜腸上皮化生、胃息肉、殘胃、胃巨大皺褶徵、慢性胃潰瘍和胃上皮異型增生等病變以及有腫瘤家族史的對象,應根據醫師建議定期作胃鏡檢查。
預防建議1.健康的飲食習慣和飲食結構,不暴飲暴食;2.根除幽門螺旋桿菌感染;3.減少食用生冷、辛辣、過熱、過硬的食物及熏制、醃製等高鹽食物;4.戒菸;5.少喝或不喝烈性酒;6.放鬆心情,合理減壓。

高危對象
1.年齡>50歲的男性;2.年齡>45歲且具有前列腺癌家族史的男性;3.年齡>40歲且基線PSA>1μg/L的男性;具有以上前列腺癌高危因素的男性,需提高警警惕,必要時進行有針對性的檢查,對異常結果進行合理隨訪。
篩查建議1.建議對身體狀況良好,且預期壽命在10年以上的男性開展基於PSA檢測的前列腺癌篩查,且在篩查前應詳細說明前列腺癌篩查的風險和獲益;2.血清PSA檢測每2年進行1次,根據患者的年齡和身體狀況決定PSA檢測的終止時間;3.對於前列腺癌高危人群應儘早開展基於血清PSA檢測的篩查;4.不建議針對40歲以下男性進行人群篩查。
預防建議1.避免吸煙、飲酒等不良生活習慣;2.減少高動物脂肪的食物攝入,因為這些食物中含有較多的飽和脂肪酸;增加蔬菜水果攝入;3.避免過於辛辣的食物,因為這些食物會造成前列腺的過度充血;4.日常生活中多飲水,勤解尿。避免憋尿、久坐不動;5.建議適度體育運動。

高危對象1.童年期頭頸部放射線照射史或放射線塵埃接觸史者;2.由於其它疾病,頭頸部進行過放療的患者;3.有分化型甲狀腺癌(DTC)、甲狀腺髓樣癌或多發性內分泌腺瘤病2型(MEN2型)、家族性多發性息肉病及某些甲狀腺癌綜合徵(如Cowden綜合徵、Carney綜合徵、Werner綜合徵和Gardner綜合徵等)的既往史或家族史(有血緣關係);4.甲狀腺結節>1cm,且結節生長迅速,半年內增長到1cm以上;5.甲狀腺結節>1cm,伴持續性聲音嘶啞、發聲困難、伴吞嚥困難或呼吸困難,並可排除聲帶病變(炎症、息肉等);6.甲狀腺結節>1cm,伴頸部淋巴結腫大;7.降鈣素高於正常範圍者。凡有上述情況之一者,均係高危甲狀腺癌對象。
篩查建議1.甲狀腺篩查要同時進行功能檢查和形態檢查。2.一般人群目前沒有用於甲狀腺癌早期檢測或常規篩查的標準試驗。臨床頸部體檢:20-29歲每2~3年1次,30歲以後每年1次。頸部超聲檢查:30歲後每年1次(包括甲狀腺、頸部、鎖骨上)。3.甲狀腺癌高危人群頸部超聲(包括甲狀腺、頸部、鎖骨上)檢查,每年一次。4.女性孕前和哺乳期結束時,建議分別進行一次頸部超聲檢查。
預防建議1.避免頭頸部放射線照射和放射性塵埃接觸史;2.健康生活,合理飲食,增加運動;3.合理疏導情緒不良。

高危對象1.放射線照射史或放射性塵埃接觸史者;2.感染及慢性炎症患者;3.免疫功能低下,有自身免疫性疾病或器官移植史者。
篩查建議1.一般人群臨床體檢,每2~3年1次。2.高危人群臨床體檢,每年1次。3.上述臨床體檢包括以下項目:①外科體檢:淺表淋巴結和肝臟脾臟觸診;②B超檢查:淺表淋巴結、肝臟脾臟和腹腔淋巴結;③血常規。
預防建議1.避免放射線照射和放射性塵埃接觸;2.健康生活,加強運動等體育鍛煉;3.積極治療自身免疫性疾病或慢性炎症;4.合理疏導情緒不良。
高危對象年齡>40歲,並符合下列任一項危險因素者:1.來自我國食管癌高發區;2.有上消化道症狀,如噁心、嘔吐、腹痛、反酸、進食不適等症狀;3.有食管癌家族史;4.患有食管癌前疾病或癌前病變;5.具有食管癌高危因素如吸煙、重度飲酒、頭頸部或呼吸道鱗癌等。
篩查建議食管癌高危人群普通內鏡檢查,每2年一次;內鏡檢查病理提示輕度異型增生,每年1次內鏡檢查;內鏡檢查病理提示中度異型增生,每半年1次內鏡檢查。
預防建議1.不吸煙或戒菸;2.少量飲酒或不飲酒;3.合理飲食,多食用新鮮水果蔬菜;4.增強運動,保持健康體重。

高危對象具備下述高危因素者,均係皮膚癌高危對象:1.經常暴晒與紫外線照射;2.長期接觸化學性物質,如瀝青、焦油衍化物;3.患有慢性潰瘍、經久不癒的疤痕,瘻管、盤狀紅斑狼瘡、放射性皮炎等;4.曾患有皮膚癌;5.持續增大或近期生長明顯的胎記;6.足底、掌心等易接觸摩擦部位長痣。
篩查建議臨床體檢,每年一次。有高危因素者,由專業的醫生進行皮膚檢查,包括痣、胎記或其他色素異常區域,記錄顏色、大小、形狀或質地的變化,必要時進行活檢。
預防建議1.定期皮膚自查(以尺比對,拍照備用);2.戶外做好物理或化學防曬,避免暴晒;3.足趾或皮膚色斑勿自行反復修剪或弄破;4.合理飲食,忌辛辣、刺激性食物。
高危對象40歲以上,伴有下述任意1項者(第6項因素會增加胰腺癌風險,但一般不做篩查):1.有胰腺癌家族史、糖尿病史;2.有長期吸煙、飲酒、高脂肪和高蛋白飲食史;3.無明顯誘因的中上腹飽脹不適、腹痛,出現食慾不振、乏力、腹瀉、消瘦或腰背部酸痛等症狀;4.慢性胰腺炎反復發作者,尤其合併胰管結石的慢性胰腺炎;主胰管型粘液乳頭狀瘤、粘液性囊性腺瘤,實性假乳頭狀瘤患者,有血清CA19-9升高者;5.無家族遺傳史的新近突發糖尿病患者;6.有幽門螺桿菌(HP)陽性、口腔牙周炎史者。
篩查建議1.上述對像以CA19-9等腫瘤標誌物的血檢結果結合腹部CT、MRI進行篩查,B超也能提供相應的幫助;2.上述人群尤其是有家族史者和已有胰腺病變者每年一次CT或MR檢查。
預防建議1.戒菸、控酒;2.提倡清淡、易消化、低脂肪飲食;3.多食禽類、魚蝦類食物,提倡食用“十”字花科蔬菜,如青菜、白菜、蘿蔔、西蘭花等;4.提倡戶外有氧活動;5.為防止良性病變惡化,有胰管結石、導管內粘液乳頭狀瘤和囊性腺瘤或其他胰腺良性病變患者應及時就醫。
高危對象1.慢性結石性膽囊炎患者(結石越大風險越高);2.長有膽囊息肉(直徑超過1厘米,特別是單發、寬蒂息肉)者;3.瓷化膽囊或膽囊萎縮者;4.膽胰管匯合異常或先天性膽管囊腫患者;5.膽囊腺肌症患者;6.慢性傷寒感染人群;7.原發性硬化性膽管炎人群;8.炎症性腸病人群;9.合併糖尿病人群。
篩查建議1.高危人群:建議每6個月行血清CEA、CA199和肝膽B超檢查;2.一般人群:建議每年行血清CEA、CA199和肝膽B超檢查,尤其是女性。
預防建議1.超過1厘米的膽囊息肉、超過1厘米的膽囊腺肌病患者,建議限期行膽囊切除術;有症狀的慢性結石性膽囊炎、膽囊萎縮、瓷化膽囊以及小於1厘米的膽囊腺肌症病患者,建議儘早行膽囊切除術。2.按照篩查建議進行定期體檢。

高危對象腦部腫瘤的十大早期信號:1.頭痛,常常清晨發作,較劇烈,起床輕度活動後逐漸緩解或消失;2.噴射狀嘔吐;3.視力模糊,視覺障礙;4.精神異常,常常有興奮、躁動、憂鬱、壓抑、遺忘、虛構等表現;5.單側肢體感覺異常,痛覺、溫覺、震動覺減退或消失;6.幻嗅;7.偏癱或踉蹌、醉酒步態;8.耳鳴、耳聾,多在打電話時,一耳聽到,另一耳聽不到;9.巨人症;10.幼兒發育停止。
篩查建議重視腦部腫瘤的十大早期信號,需要到神經科或相關科室(眼科,耳鼻咽喉科,神經外科等)進一步檢查。
預防建議1.健康生活,避免熬夜;2.增加戶外鍛煉和運動,保持合理體重;3.合理飲食。
以上是肺癌、大腸癌、肝癌、胃癌、乳腺癌、宮頸癌和前列腺癌、甲狀腺癌、淋巴瘤、食管癌、皮膚癌、胰腺癌、膽囊癌和腦部腫瘤等14個惡性腫瘤的預防和早診早治權威科普信息,希望每一個人更夠重視健康,科學合理的做好早期篩查!
支持生物醫藥產業發展;允許臨床試驗階段的藥物和器械有條件用於臨床患者;鼓勵公立醫療衛生機構優先使用創新技術和產品……
”2019 12月16日,上海市衛生健康委發布《關於加強本市醫療衛生機構臨床研究支持生物醫藥產業發展的實施方案》(下稱《方案》),以完善上海臨床研究體系,支持生物醫藥產業發展。
建設研究型醫院臨床數據向企業有序開放
《方案》提出推進上海市建設研究型醫院,基於國家醫學中心和國家臨床醫學研究中心建設,強化“醫工結合”。
到2020年底,上海將重點建設5家研究型醫院,使其成為重大疑難疾病的診療平台、臨床研究和技術創新的主體,引領本市和國家臨床研究發展。同時,到2020年,上海還要建設約15家上海市臨床醫學研究中心、5個醫學協同創新集群,所有市級醫院均將內設專門的臨床研究機構。
《方案》提出,到2030年,上海將湧現一批世界級的研究型醫院,產出一批具有全球影響力的原創成果,成為全球醫學創新網絡的重要樞紐。
此外,上海還將推動醫學公共資源開放共享,建立市級醫療衛生機構臨床生物樣本庫、基因庫、標準化菌毒種庫、生物醫學數據庫和醫學科研數據庫等資源開放共享機制,將臨床數據向企業有序開放。
臨床研究納入醫院績效考核
為鼓勵醫療衛生機構參與臨床研究,《方案》提出,完善醫療衛生機構考評體系,將臨床研究納入市級公立醫院、市級醫院院長績效考核指標和三級甲等醫療機構等級評審指標。市級醫院的病床在實際用於臨床研究期間,不計入總病床考核指標。
承擔臨床研究工作的醫療衛生機構,還可以適當提升高級職稱結構比例,依託所屬高校申報臨床研究博士後流動站、工作站。
為鼓勵醫務人員參與臨床研究,《方案》提出,探索設立技術轉移專業崗位,為技術轉移人才提供晉升通道。臨床研究人才評價要重點突出創新成果和成果轉化,臨床研究業績可作為臨床研究人員職稱(職務)評聘、崗位聘用的重要依據。在經認定的單位開展科研人員職稱申報不受崗位缺額限制的試點。
鼓勵臨床醫師、公共衛生醫師和藥師等參與臨床研究,將臨床研究工作業績納入高級職稱申報考核內容。
是領導,也能獲取股權獎勵
《方案》支持市級醫療衛生機構率先建立科研成果轉化機構,專門從事科研成果轉化工作;支持醫療衛生機構委託第三方服務機構,開展技術轉移服務。
允許醫療衛生機構和臨床研究人員共有成果所有權,鼓勵醫療衛生機構授予臨床研究人員可轉讓的成果獨占許可權。
具有獨立法人資格的醫療衛生機構領導人員,作為臨床研究成果主要完成人或對研究成果轉化作出重要貢獻的,可獲得現金、股權或出資比例獎勵。對正職領導人員給予股權或出資比例獎勵的,需經單位主管部門批准,且任職期間不得進行股權交易。
專職臨床研究人員經所在單位同意,可外出兼職、離崗創業,兼職或離崗創業收入不受本單位績效工資總量限制。
允許臨床試驗階段的藥物和器械用於患者
《方案》聚焦前沿醫療技術升級,聚集基因技術、腦科學、微生物組計劃、人工智能、可穿戴設備和醫療大數據等健康前沿領域。未來,上海將大力開展針對退行性疾病、代謝性病變和腫瘤病人的細胞治療、微創技術、基因組學等新業務、新技術,力求在腫瘤醫學、老年醫學、康復醫學、生殖醫學和神經醫學研發應用上有所突破。
同時,上海還將推動生物醫藥製造業升級,通過院校合作、院企合作、院所合作、醫工合作等多種形式,支持分子藥物、納米藥物與醫用新材料的研發,促進3D打印、激光、質子與重離子、量子等新技術在醫療領域的應用。
為推進生物治療技術和重大創新產品的臨床應用,《方案》提出,推動干細胞、免疫細胞治療等先進生物治療技術的臨床應用試點,加快支持新項目立項進入臨床,加大支持優質創新技術研發。在價格適宜、療效確切的基礎上,按照國家醫療保障局有關規定,將符合條件的創新技術、項目納入醫保支付範圍。
《方案》允許臨床試驗階段的藥物和器械有條件用於臨床患者。對正在開展臨床試驗的用於治療嚴重危及生命且尚無有效治療手段的疾病的藥物,經醫學觀察可能獲益、並且符合倫理原則的,經審查、知情同意後,可以在開展臨床試驗的機構內用於其他病情相同的患者。允許開展醫療器械拓展性臨床試驗。
《方案》鼓勵公立醫療衛生機構優先使用創新技術和產品,將上海創新產品(大型設備、藥品、高值耗材、體外診斷試劑等)使用情況納入公立醫院績效考核指標體系,同時,結合醫療衛生對口支援、培訓等工作,宣傳推廣本市生物醫藥創新產品。
關於加強本市醫療衛生機構臨床研究
支持生物醫藥產業發展的實施方案
為完善本市臨床研究體系,支持生物醫藥產業高質量發展,根據《關於進一步深化科技體制機制改革增強科技創新中心策源能力的意見》(滬委辦〔2019〕78號)、《關於推進本市健康服務業高質量發展加快建設一流醫學中心城市的若干意見》(滬府發〔2018〕25號)和《關於促進本市生物醫藥產業健康發展的實施意見》(滬府辦發〔2017〕 51號)要求,現制定本方案。
一、工作原則
堅持需求導向。按照市委、市政府的決策部署,牢牢把握“四個放在”的工作基點和全球生物醫藥產業發展新機遇,以生物醫藥產業發展需求為導向,聚焦臨床研究、成果轉化、臨床應用等產業發展關鍵環節,精準發力,支持上海生物醫藥產業向產業鏈中高端轉型升級。
堅持聯動發展。搭建臨床醫療與生物醫藥產業聯動發展機制與平台,推動院校合作、院企合作、院所合作、醫工合作,加強臨床醫療發展規劃、重大項目建設與生物醫藥產業發展的銜接,逐步實現臨床醫療與生物醫藥產業相互帶動、相互支撐、協同發展,促進生物醫藥產業高端化、智能化、國際化發展。
堅持創新驅動。以製度創新激發醫學科技創新的活力,調動醫療衛生機構、醫務人員參加臨床研究、成果轉化的積極性,引領生物醫藥重大產品創新,服務於亞洲醫學中心城市建設。到2020年,形成與卓越的全球城市能級相匹配的臨床研究和應用支持體系,臨床研究能力達到亞洲先進水平。
堅持群眾受益。堅持以人民健康為中心,聚焦重大疾病臨床診治和重大生物醫藥產品創新,提高臨床研究策源力,支持創新藥品和器械研發應用,不斷提高臨床醫療水平和質量,不斷增進人民健康福祉。
二、主要任務
(一)推進研究型醫院建設
1.推進一批研究型醫院建設。制定研究型醫院建設標準,強化臨床研究能力、臨床診治能力、成果轉化能力的評價。基於國家醫學中心和國家臨床醫學研究中心建設,強化“醫工結合”,到2020年底,本市重點建設5家研究型醫院,成為重大疑難疾病的診療平台、臨床研究和技術創新的主體,引領本市和國家臨床研究發展;到2030年,湧現一批世界級的研究型醫院,產出一批具有全球影響力的原創成果,成為全球醫學創新網絡的重要樞紐。強化重中之重學科建設,結合上海市臨床重點專科建設“騰飛計劃”,到2020年,建設15家左右上海市臨床醫學研究中心、5個醫學協同創新集群。在市級醫院推進臨床研究機構建設,所有市級醫院均內設專門的臨床研究機構。(牽頭部門:市衛生健康委、市科委、市發展改革委、市財政局)
2.完善研究型醫院支持政策。支持研究型醫院主持和參與國際多中心臨床研究,在精準醫學、轉化醫學等重點領域取得突破,形成一批具有國際話語權的重大疾病診治規範和標準,學科建設與臨床研究接近國際先進水平,重大疑難疾病的診治能力保持全國領先。優化研究型醫院的臨床研究人員與臨床醫師比例,完善臨床研究人員培養體系、職稱評定標準和評價體系,改革臨床研究人員績效考核辦法。(牽頭部門:市衛生健康委、市科委、市人力資源社會保障局)
(二)促進臨床研究資源共享與合作
3.促進本市醫學公共資源開放共享。建立市級醫療衛生機構臨床生物樣本庫、基因庫、標準化菌毒種庫、生物醫學數據庫和醫學科研數據庫等資源開放共享機制。建立臨床數據向企業有序開放機制,推動本市衛生健康信息平台向臨床研究提供數據支持,進一步支撐臨床研究和生物醫藥產業發展。建立開放共享的醫學科研公共設施,以市級醫院臨床研究資源為核心,建設上海臨床研究平台,推動實驗室等公共設施開放共享。(牽頭部門:市衛生健康委、市科委、市經濟信息化委、市藥品監管局)
4.加強長三角臨床研究合作。推進長三角臨床研究戰略協作,協同打造國家或國際領先的優勢學科群。推進科研基礎設施共享,建設長三角罕見病實驗診斷協作中心,加強數據共享。聯合推進重大疾病科研項目攻關,開展新藥、新診療方案臨床試驗,加強聯合研發轉化。(牽頭部門:市衛生健康委、市發展改革委、市科委、市經濟信息化委、市藥品監管局)
5.融入國際醫學科技合作網絡。加強國際醫學科技合作交流,支持本市醫療衛生機構和科研團隊融入全球醫學科技創新網絡,與“一帶一路”沿線國家(地區)共建聯合實驗室和研發基地,服務國家和本市醫學科技重大戰略。對醫學科研人員(包括“雙肩挑”科研人員)因學術交流合作需要臨時出國的,在出訪次數、團組人數和在外天數等方面,根據工作需要據實安排。特殊情況下,經所在單位和主管部門批准,科研人員可持普通護照出國,提高科研人員參與國際合作交流的便利性。(牽頭部門:市衛生健康委、市科委)
6.建立醫療技術轉化平台。堅持市場主導,利用國家轉化醫學中心、上海醫藥臨床研究中心等平台,搭建醫療技術協作與轉化平台,推進臨床研究網絡建設,推動具有自主知識產權的成果實現臨床轉化應用與推廣。建設醫學人工智能研發和轉化平台。發揮生物醫藥園區、行業協會、醫療科技類社會組織、展會平台等相關市場主體的作用,建立“產學研醫”對接平台,推動臨床研究成果對接轉化,培育國際一流的生命健康產業集群。(牽頭部門:市衛生健康委、市發展改革委、市科委、市經濟信息化委、市藥品監管局)
7.組建專業臨床研究聯盟。以本市臨床試驗機構所屬專業或亞專業為切入點,試點建立專業臨床研究聯盟,為臨床研究提供試驗設計、研究者篩選、倫理審查、GCP核查、患者招募、藥物警戒、生物統計等全方位服務,並實現統一的業務申請受理、醫學倫理審查、業務資源分配、質控標準建設、信息發布渠道、項目監督評價和數據交換使用。(牽頭部門:市衛生健康委、市科委、市經濟信息化委、市藥品監管局)
8.建設市級和區域臨床研究倫理委員會。推進本市和區域臨床研究倫理委員會建設,完善倫理審查標準操作體系、質量認證體系、專業培訓體系和科研諮詢體系,促進臨床科研項目倫理審查規範化,提高醫學倫理審查水平和效率。鼓勵參與多中心臨床試驗的成員單位認可臨床試驗組長單位的倫理審查結論,原則上不再重複審查。(牽頭部門:市衛生健康委、市科委、市藥品監管局)
(三)鼓勵醫療衛生機構和醫務人員參與臨床研究
9.鼓勵醫療衛生機構加強科研成果轉化組織建設。支持市級醫療衛生機構率先建立科研成果轉化機構,專門從事科研成果轉化工作。鼓勵和支持醫療衛生機構委託第三方服務機構開展技術轉移服務。(牽頭部門:市衛生健康委、市科委、市經濟信息化委、市藥品監管局)
10.推動醫療衛生機構臨床研究項目庫建設。加強部門協同,加大對醫療衛生機構內“臨門一腳”的生物醫藥臨床研究項目的支持力度,培育更多的生物醫藥創新產品。(牽頭部門:市衛生健康委、市科委、市經濟信息化委、市藥品監管局)
11.完善醫療衛生機構考評體系。將臨床研究工作納入市級公立醫院、市級醫院院長績效考核指標體系。對開展臨床研究的市級醫院,經認定用於臨床研究的病床在實際用於臨床研究的使用期間,不計入醫療機構總病床考核,不考核病床效益、周轉率、使用率等指標。將臨床研究條件和能力納入三級甲等醫療機構等級評審指標要求,鼓勵和引導高水平醫療衛生機構開展臨床研究。(牽頭部門:市衛生健康委)
12.優化臨床研究人才評價體系。在醫療衛生機構探索設立技術轉移專業崗位,為技術轉移人才提供晉升通道。臨床研究人才評價要重點突出創新成果和成果轉化,臨床研究業績可作為臨床研究人員職稱(職務)評聘、崗位聘用的重要依據。在經認定的單位開展科研人員職稱申報不受崗位缺額限制的試點。鼓勵臨床醫師、公共衛生醫師和藥師等參與臨床研究,將臨床研究工作業績納入高級職稱申報考核內容。對承擔臨床研究工作的醫療衛生機構,適當提升其高級職稱結構比例,並鼓勵依託所屬高校申報臨床研究博士後流動站、工作站。(牽頭部門:市衛生健康委、市人力資源社會保障局)
13.建立以增加知識價值為導向的績效激勵機制。研究制定本市醫療衛生機構臨床科研績效激勵辦法。競爭性科研項目中用於科研人員的勞務費用、間接費用中績效支出,經過技術合同認定登記的技術開發、技術諮詢、技術服務等活動的獎酬金提取,職務科技成果轉化獎酬支出,均不納入單位績效工資總量。專職臨床研究人員經所在單位同意,可到企業和其他科研機構、高校、社會組織等兼職並取得合法報酬,可離崗從事臨床科技成果轉化等創新創業活動,兼職或離崗創業收入不受本單位績效工資總量限制。(牽頭部門:市衛生健康委、市人力資源社會保障局、市科委、市財政局)
14.改革臨床研究成果權益管理。允許醫療衛生機構和臨床研究人員共有成果所有權,鼓勵醫療衛生機構授予臨床研究人員可轉讓的成果獨占許可權。具有獨立法人資格的醫療衛生機構領導人員作為臨床研究成果主要完成人或對研究成果轉化作出重要貢獻的,可獲得現金、股權或出資比例獎勵。對正職領導人員給予股權或出資比例獎勵的,需經單位主管部門批准,且任職期間不得進行股權交易。(牽頭部門:市衛生健康委、市人力資源社會保障局)
(四)加快臨床研究重點領域突破
15.聚焦支撐前沿醫療技術升級。聚焦基因技術、腦科學、微生物組計劃、人工智能、可穿戴設備和醫療大數據等健康前沿領域,大力開展針對退行性疾病、代謝性病變和腫瘤病人的細胞治療、微創技術、基因組學等新業務、新技術,力求在腫瘤醫學、老年醫學、康復醫學、生殖醫學和神經醫學研發應用上有所突破。(牽頭部門:市衛生健康委、市發展改革委、市科委、市經濟信息化委、市藥品監管局)
16.聚焦支撐生物醫藥製造業升級。通過院校合作、院企合作、院所合作、醫工合作等多種形式,支持分子藥物、納米藥物與醫用新材料的研發,促進3D打印、激光、質子與重離子、量子等新技術在醫療領域的應用,發展更加安全、有效的臨床治療新藥物、新設備、新技術,帶動藥品、醫療器械等的科技研發和成果轉化,協助企業推出更多適應國內外醫藥市場的新產品,支持醫藥器械等傳統健康產業改造升級、跨步躍升。(牽頭部門:市衛生健康委、市發展改革委、市科委、市經濟信息化委、市藥品監管局)
(五)推進生物治療技術和重大創新產品臨床應用
17.推動和優化新型個體化生物治療技術臨床應用管理。落實國家《醫療技術臨床應用管理辦法》,制定本市生物治療技術臨床應用管理規範,加快建立臨床應用質控體系。爭取乾細胞、免疫細胞治療等先進生物治療技術的臨床應用試點。支持新型個體化生物治療產品標準化、規範化應用。加快支持新項目立項進入臨床,加大支持優質創新技術研發,在價格適宜、療效確切的基礎上,按照國家醫療保障局有關規定,將符合條件的創新技術、項目納入醫保支付範圍。(牽頭部門:市衛生健康委、市醫保局、市科委、市經濟信息化委)
18.允許臨床試驗階段的藥物和器械有條件用於臨床患者。對正在開展臨床試驗的用於治療嚴重危及生命且尚無有效治療手段的疾病的藥物,經醫學觀察可能獲益、並且符合倫理原則的,經審查、知情同意後,可以在開展臨床試驗的機構內用於其他病情相同的患者。允許開展醫療器械拓展性臨床試驗。(牽頭部門:市衛生健康委、市藥品監管局、市科委)
19.鼓勵公立醫療衛生機構優先使用創新技術和產品。落實本市創新產品政府首購和訂購、“三首”(裝備首台套、材料首批次、軟件首版次)應用示範等政策,支持醫療創新產品優先進入公立醫院使用。在乙類大型醫用設備配置規劃數量中,安排部分配置規劃數用於支持醫療衛生機構裝備創新產品。將本市創新產品(大型設備、藥品、高值耗材、體外診斷試劑等)使用情況納入公立醫院績效考核指標體系。結合醫療衛生對口支援、培訓等工作,宣傳推廣本市生物醫藥創新產品。(牽頭部門:市衛生健康委、市科委、市經濟信息化委)
20.支持中醫藥臨床研究與成果轉化。推進上海市中醫藥循證醫學研究中心及其臨床研究分中心建設,強化公共服務與技術支撐平台功能,提升醫療衛生機構中醫藥臨床研究能力。支持中藥新藥、中醫醫療器械的國際多中心臨床研究,鼓勵開展中成藥大品種臨床再評價,推動基於名老中醫經驗方、經典名方、醫療機構中藥製劑的藥物和醫療器械開發,推進中西醫臨床協同攻關。完善醫療機構中藥製劑註冊和備案、臨床應用等相關政策。(牽頭部門:市中醫藥管理局、市衛生健康委、市科委、市經濟信息化委、市藥品監管局)
三、完善領導和保障
21.建立臨床研究體系建設聯席會議制度。依托聯席會議,及時溝通解決臨床研究體系建設中的問題。加大對臨床研究的投入,加強對臨床研究機構建設、人才隊伍培養和臨床研究信息化建設項目的支持。(牽頭部門:市衛生健康委、市發展改革委、市科委、市經濟信息化委、市藥品監管局)
22.建立多元化的臨床研究資金籌集渠道。依托上海市醫藥衛生髮展基金會等籌資渠道,推進臨床研究資金籌集多元化,並完善管理機制,提高臨床研究資金使用效率和資助強度,集中力量辦大事。(牽頭部門:市衛生健康委、市發展改革委、市科委、市經濟信息化委、市財政局)
23.加強臨床研究人才隊伍培養。完善臨床研究人員和臨床研究管理人員的出國培訓機制,培養一批具有臨床研究思維的高水平人才隊伍。加強醫務人員臨床研究相關領域的法律法規培訓。充分利用本市人才政策,吸引更多海外專家學者、醫學留學生來滬參與臨床研究工作,鼓勵醫療衛生機構聘用外籍人才擔任重點實驗室、研發中心等機構的負責人。繼續推進醫務職工科技創新活動,營造良好的創新文化。(牽頭部門:市衛生健康委、市人力資源社會保障局、市科委)
24.推進臨床研究信息化建設。依托現有信息化網絡平台和數據中心,加強數據分級分類的分析應用,按照信息和網絡安全相關法律法規要求,強化臨床研究數據採集、管理、安全和共享功能,提供臨床研究數據服務。(牽頭部門:市衛生健康委、市發展改革委、市科委、市經濟信息化委)
文章來源:上海市衛生健康委員會
CAR-T 市場再起漣漪! Cellectis 獲得 CRISPR 美國專利!
BY GENEONLINE ON 二月 27, 2018專利與法規, 專題報導
CRISPR/Cas9 為近年來最夯的基因編輯工具,它具有龐大的醫學應用潛力以及龐大的商機,Editas Medicine(張峰博士研究團隊)、CRISPR Therapeutics、Intellia Therapeutics、Caribou Biosciences、ERS Genomics、Cellectis 等生技公司都致力於開發效率更好、更便宜的 CRISPR 技術,也都申請專利或取得授權來保護公司的利益。
法國生技公司 Cellectis 分別於今年 1 月 2 日和 2 月 13 日,取得二項與 CRISPR 相關的美國專利,專利號分別為 US9855297 和 US9890393,專利名稱皆為 「透過使用RNA引導的CAS核酸酶系統設計用於免疫療法的T細胞的方法」(Methods for engineering T cells for immunotherapy by using RNA-guided CAS nuclease system),該方法對 T 細胞進行工程化,以增加或刪除 T 細胞基因體中的特定特徵,主要專利範圍(claim)請見表一。
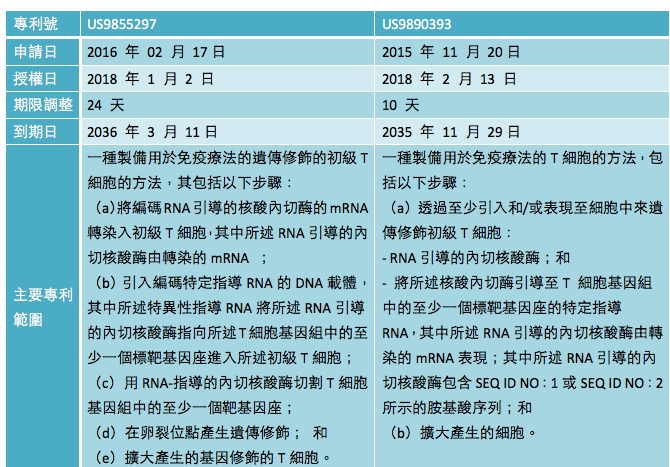
表一、Cellectis 於美國獲得 CRISPR 編輯 T 細胞的專利
諾華(Novartis)、Juno Therapeutics 和 Gilead Sciences (2017 年 8 月收購 Kite Pharma)等生技醫藥公司也有各自的嵌合抗原受體 T 細胞(Chimeric antigen receptor T cells,CAR-T 細胞)以及其專利保護(表二),但他們的 CAR-T 療法不是同種異體,而是自體的,他們提取 T 細胞來自患者,增加嵌合抗原受體,使T細胞識別癌細胞,並且重新將 T 細胞注入到患者的血液中。然而,Cellectis與這些公司的研發走向不同,他們正在開發可廣泛使用的通用 CAR-T 細胞系。
Cellectis 確信他們持續研發CAR-T 細胞,未來將產生巨大價值,因此 Cellectis 願意將這二項專利授權給有意願在 T 細胞中使用 CRISPR 技術的公司。例如,藉由這二項專利的技術知識,來幫助其他公司設計同種異體 CAR-T 細胞(allogeneic CAR T-cells,UCART),同時也能抑制檢查點抑制劑(checkpoint inhibitions)的基因(例如:PD-1)、工程抗藥性或去除主要組織相容性複合體(Major Histocompatibility Complex,MHC)相關基因。該技術也可用於通過標靶 T 細胞基因體中特定基因座的基因來插入 DNA-CAR構建體(construct)。
資料來源: GENE online https://geneonline.news/index.php/2018/02/27/cellectis-crispr-cart-us-patent/?doing_wp_cron=1576804543.7374548912048339843750
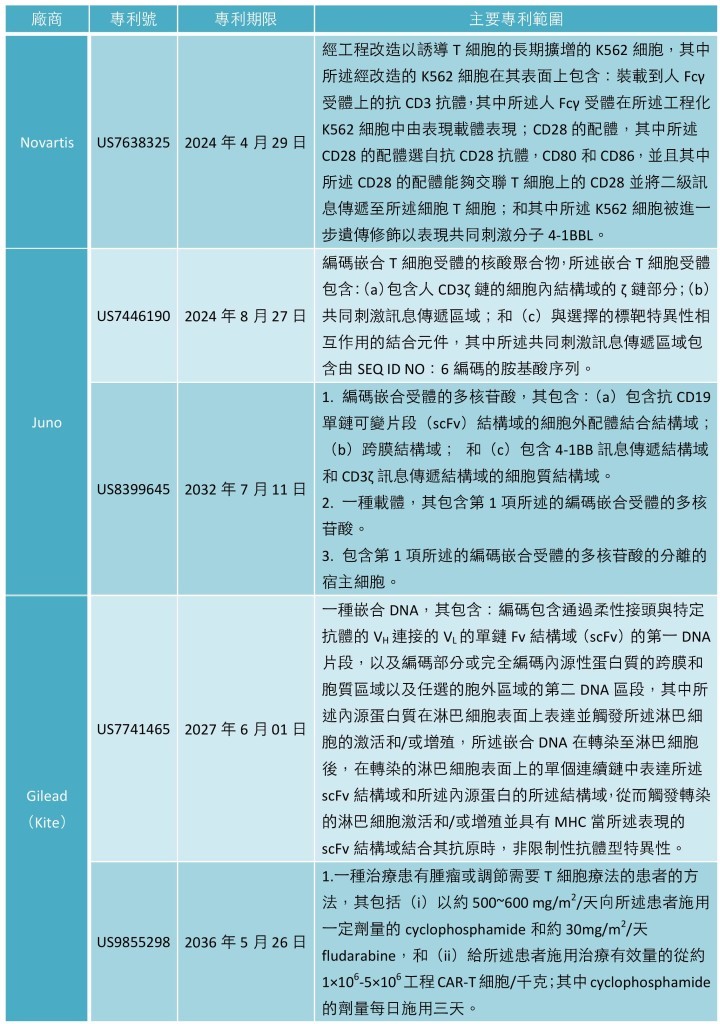
表二、Novartis、Juno、Gilead(Kite)擁有的 CAR-T 細胞相關專利
文 / Parker Yang
參考資料:
1. https://www.businesswire.com/news/home/20180212006461/en/Issued-U.S.-Patents-Granted-Cellectis-CRISPR-T-Cells
2. https://www.biopharma-reporter.com/Article/2018/02/14/Cellectis-wins-patents-for-CRISPR-gene-editing-in-T-cells
3. https://opinioninvestor.com/crispr-and-crispr-associated-genes-market-rising-demand-technology-acquisitions-research-analysis-2018-2025/9027/
5. https://www.genengnews.com/gen-exclusives/car-t-in-the-courts/77900974
6. http://ir.kitepharma.com/releasedetail.cfm?releaseid=1031614
7. US Patent 9855297
8. US Patent 9890393
9. US Patent 7446190
10. US Patent 8399645
11. US Patent 7638325
12. US Patent 7741465
13. US Patent 9855298
近年來,細胞療法在整個生物製藥行業中獲得了極大的關注,被認為具有潛力解決當前未得到滿足的臨床需求。全球已經有大約20多種細胞療法獲得批准,同時500多種基於細胞的治療方案處在臨床開發的不同階段中。隨著細胞治療候選方案的持續增加,以及臨床開發的快速發展,整個行業對細胞製造相關設備平台和服務的需求不斷增加。
當前,細胞製造已經形成了龐大的市場。根據全球市場研究與諮詢機構 Roots Analysis 發布的報告,全球細胞製造市場有望穩步增長,到2030年市值預計將達到110億美元,年增長率為14.9%。這個市場擁有著廣泛的行業參與者,包括知名企業、中型企業和初創企業,以及對 GMP 級細胞生產做出重大貢獻的學術機構等等;一些參與者提供了新穎的技術解決方案,不斷改善和升級現有的細胞製造工藝,進一步推動了全球細胞製造市場的發展。
這份報告指出,自動化已經成為細胞製造的關鍵推動因素,並列舉了當前正為細胞治療的開發和商業化提供自動化解決方案的一些企業。
細胞製造
新一輪製造業的革命性創新與突破
近年來,許多國家正在著力尋找新產業、新業態、新模式等能夠帶來巨大市場潛力的高新技術產業突破,而細胞治療產業正是一個新型的突破口,被許多國家推向了戰略高層。細胞製造是細胞治療產業的核心環節,已經成為各國競爭的戰略制高點,美國為此專門製定了面向 2025 年的先進細胞製造技術路線圖、英國把自身定位為細胞治療彈射器、德國還設立了德累斯頓再生治療中心等。細胞製造將掀起新一輪製造技術的革新性創新與突破。
2016 年,美國國家細胞製造協會發布了《面向 2025 年大規模、低成本、可複制、高質量的細胞製造技術路線圖》,用於設計大規模生產用於癌症、神經退行性疾病、血液和視覺障礙和器官再生和修復的細胞治療產品的路徑。這一路線圖標誌著美國細胞製造由規劃進入到落實、實現產業化發展的階段。
在中國,細胞治療已經被視作重大科技項目列入國家“十三五”科技創新規劃中,同時規模化、標準化、產業化的細胞製備也受到了高度重視。2018年國內細胞治療領域的領軍人物解放軍總醫院韓為東教授在《生物技術進展》(Biotechnology Advances )雜誌上呼籲標準化各國的細胞製造和法規,並倡議使用封閉式自動化系統。2017 年頒布的《細胞治療產品研究與評價技術指導原則(試行)》也強調了研究者應不斷優化製備工藝,減少物理、化學或生物學作用對細胞的特性產生非預期的影響,盡量達到自動化、全封閉的生產。
新一代細胞製造工藝將成為主流
在過去,細胞製造常常以傳統人工為主,然而傳統的人工操作不僅效率低,還難以保證穩定性。依託於自動化技術的新一代細胞製造工藝成為了行業發展的趨勢。目前,包括諾華和吉利德等擁有上市細胞療法的巨頭企業也正在追求細胞製造自動化。
細胞製造涉及到細胞的活性和穩定性,是一個對質控有嚴格要求的繁瑣過程。食藥監總局藥品審評中心生物製品臨床部部長高晨燕在接受媒體採訪時曾表示,“如果我們的產品要供應全國,要送到華北地區、華東地區,多家醫院需要達到相同的質量標準。這種規模化,我們還沒有達到。”
自動細胞製造化工藝是解決質量控制難題的關鍵,國內這一市場仍有著很大的發展空間,未來擁有自動化生產工藝的細胞治療項目有望優先獲益。由此可見,基於自動化技術的細胞處理及製造正漸漸成為推動行業發展的主流。
參考資料:[1] Roots Analysis:Cell Therapy Manufacturing Market (2nd Edition), 2018-2030[2] Biotechnology Advances: Standardizing CAR-T therapy: Getting it scaled up[3] French CDMO to Make Kymriah as Part of Novartis CAR-T Strategy[4] Placing your CAR-T bets
2019.08.17環球生技雜誌/記者 巫芝岳

免疫、幹細胞療法應用廣 但須慎防致癌等嚴重副作用(攝影:林嘉慶)
環球生技與聯合報健康事業部聯合主辦的「認識你的細胞經濟學論壇」中,邀請來自產官學研界專家解析現今正熱門的細胞治療,透過深入淺出的介紹,增進產學界與一般聽眾對細胞治療的認識。
張文震:免疫系統複雜,成細胞療法挑戰

林口長庚醫院免疫腫瘤卓越中心主任張文震(攝影/林嘉慶)
林口長庚醫院免疫腫瘤卓越中心主任張文震,首先針對免疫與細胞療法,分享了其最新趨勢及臨床經驗。
細胞治療可分為安全性高、療效較低的「未經基因改造」療法,如自然殺手細胞、樹突細胞、T細胞等;以及,治療危險性較高,但療效較好的「基因改造」療法,如目前研發主流之一的CAR-T和TCRT療法等。
臨床數據上,目前已有相當多國外試驗,顯示CIK、TIL、自然殺手細胞、樹突細胞等細胞治療潛力可期。但由於個人化免疫治療的製備時間目前仍相當費時,比起現行癌症標準療法,引發嚴重不良反應(如:免疫風暴)的機率也較高,因此是一項各界高度關注,但在研發到實行層面,仍待持續精進的領域。
「生物的免疫系統,是經過了數百萬年演化的複雜系統,因此要在這極其複雜的機制中看到治療的再現性,往往是細胞療法研發時的最大挑戰之一。」
張文震強調,由於細胞治療的監控較複雜,且副作用可能涉及多器官,因此醫學中心也會以多科系團隊合作的方式,為病人提供完整照護。
張至宏:軟骨損傷相關再生醫療 進展可期

台灣再生醫學學會理事長張至宏(攝影/林嘉慶)
台灣再生醫學學會理事長,同時也是亞東醫院骨科部主任的張至宏,說明了軟骨缺損與退化性關節炎再生醫療的進展。
張至宏表示,目前國內軟骨損傷最常見的治療方式,是透過挖取自體軟骨組織進行修補的馬賽克手術(mosaiplasty),但手術成效仍因為完好軟骨的供體處有限,以及可能造成供體處副作用等原因,而所侷限,包括完好軟骨的供體處有限,也可能造成供體處的其他副作用;因此,若輔以再生醫療,培養軟骨組織的方式,便可使治療更加完善。
目前,針對軟骨缺損及退化性關節炎所造成的軟骨損傷,國際上所研發的細胞治療方式相當多樣,包擴利用自體骨髓間質幹細胞、自體滑膜幹細胞、異體臍帶血幹細胞等,培養出軟骨組織植入關節腔,甚至可透過以奈米磁珠輔助的方式,以磁場引導細胞定位。
本土也有相關的臨床實驗正在進行中,包含軟骨缺損治療Kartigen©以及退化性關節炎療法Regstem ASC©,前者利用自體骨髓間葉幹細胞培養,後者則取自自體間質幹細胞。
沈家寧: 幹細胞治療應用廣,但風險仍高

臺灣幹細胞學會理事長沈家寧(攝影/林嘉慶)
臺灣幹細胞學會理事長沈家寧,則深入介紹了幹細胞治療。
沈家寧表示,幹細胞不只存在於胚胎,生物成體的骨髓、腸道等某些特定組織中也富含不同種類的幹細胞,「要用幹細胞修復組織,首先要知道該如何分離培養幹細胞,接著要了解該如何誘導它們成為我們需要的細胞。」
目前,已有相當多項幹細胞相關療法研發出,例如透過骨髓移植,以造血幹細胞治療血液疾病與免疫不全疾病;以羊膜培養的幹細胞修復角膜損傷等。近年,日本也開放使用誘導型多功能幹細胞(iPSC)進行如黃斑部病變、帕金森氏症、脊髓損傷等相關的臨床研究。
然而,幹細胞治療仍存在著相當的風險,例如近年發現,骨髓幹細胞治療可能會助長惡性腫瘤生成,所以如何適當操縱幹細胞,也是研發時相當重要的。
细胞療法登上央视!CCTV講述患者细胞治療後7年無癌生存的真實故事!
科濟生物醫藥 醫麥客 2018-01-26
2018年1月26/醫麥客 eMedClub/–近日,科濟生物聯合上海市腫瘤研究所、上海交通大學附屬仁濟醫院發表了第一篇靶向GPC3的CAR-NK治療肝細胞癌的研究論文。該研究結果已於2017年12月14日發表在了權威醫學期刊Molecular Therapy,上海市腫瘤研究所研究員、科濟生物創始人李宗海博士為論文通訊作者。

公開資料顯示,肝細胞癌(Hepatocelluar Carcinoma, HCC)是全球致死率第三、發病率第六的惡性腫瘤[1]。目前,手術切除是肝細胞癌最主要的治療手段,但病人術後復發率高,且5年生存期僅有10% [2]。大量肝細胞癌患者依然缺乏精准有效的臨床治療手段。
自然殺傷細胞(natural killer cell, NK細胞)是一種重要的免疫細胞。經過CAR結構修飾後的NK細胞,能夠高效的識別腫瘤細胞,並通過釋放殺傷介質、誘導細胞凋亡等多種手段殺傷腫瘤細胞。由NK-92細胞系衍化的CAR-NK細胞,具有可批量生產並且通用型的特點受到了業界廣泛關注。
此次研究利用自主智慧財產權抗體製備的GPC3-CAR-NK細胞株(NK-92/9.28.z)在體內外均能夠特異性地靶向並殺傷表達GPC3的肝細胞肝癌,並且不受血清水準可溶性GPC3、實體瘤低氧環境和TGF-β的影響。與目前的CAR-T細胞治療相比,CAR-GPC3-NK治療方案節約大量成本。
文章連結:
http://www.cell.com/molecular-therapy-family/molecular-therapy/fulltext/S1525-0016(17)30609-3
參考文獻:
- Ferlay J, Shin HR,Bray F, Forman D, Mathers C, Parkin DM. Estimates of world burden of cancer in 2008: GLOBOCAN 2008.International journal of cancer.2010;127:2893-917
- Llovet JM RS,Mazzaferro V. Et al.Sorafenib in advanced hepatocelluar carcinoma the New England journal of medicine. 2008:359:378-90
2019年6月26日/醫麥客 eMedClub/—NantKwest宣佈,該公司的PD-L1 t-haNK新藥臨床試驗申請(IND)已經獲得FDA批准,這是該專案在局部晚期或轉移性實體瘤中的首次人體臨床試驗。
t-haNK細胞新靶點PD-L1
在獲FDA批准針對淋巴瘤患者首次使用CD19 t-haNK的雙特異性工程NK細胞治療臨床試驗後的短短幾周內,NantKwest又獲FDA批准其針對實體瘤患者使用PD-L1 t-haNK進行第二次雙特異性NK細胞治療臨床試驗。
PD-L1 t-haNK是首次設計的、GMP級的、冷凍保存的,現成的雙特異性NK細胞療法,現進入靶向實體瘤患者的PD-L1和CD16的人體臨床試驗。根據FDA批准,旨在評估PD-L1 t-haNK細胞治療實體瘤患者的安全性,耐受性和療效。完成這一安全階段後,NantKwest打算將這種PD-L1 t-haNK細胞療法與其他免疫調節劑聯合使用作為整合的一部分,包括NabFc-N803,一種IL15細胞因數超激動劑和傳遞腫瘤相關和新抗原的腺病毒/酵母載體。聯合療法旨在進一步提高這種新型NK細胞干預的治療效果,他們將其描述為NANT癌症記憶疫苗。
關於NK平臺
自然殺傷(NK)細胞是人體的一種保護措施,旨在識別和檢測由於癌症或病毒感染而處於壓力下的細胞。啟動的NK細胞平臺旨在摧毀癌症和病毒感染的細胞。該公司在臨床開發階段建立了一個領先的現成NK細胞組合。
NK誘導細胞死亡的機制:
由於具有培養活性殺傷細胞作為癌症治療的能力,我們的NK細胞被設計為通過幾種機制誘導針對癌症和病毒感染細胞的細胞死亡,包括:
1、先天殺死。所以NK平臺可以識別癌細胞上的應激蛋白,這些蛋白結合後會釋放出有毒顆粒,立即殺死目標細胞
2、haNK平臺:用抗體介導殺死細胞。該平臺經過工程改造NK細胞以表達可與治療性抗體產物結合的抗體受體,從而增強該抗體的癌細胞殺傷作用
3、taNK平臺:利用嵌合抗原受體(CAR)進行定向殺傷。該平臺的NK細胞經工程改造以嵌入抗原受體(CAR)以靶向在癌細胞表面發現的腫瘤特異性抗原。t-haNK平臺採用了三種殺滅模式(先天,抗體介導和CAR導向殺傷),是aNK,haNK和taNK平臺在單一產品中的創新組合。
t-haNK平臺下誕生的PD-L1 t-haNK細胞療法旨在通過使用CAR結構體提供精確的腫瘤細胞特異性,該結構體利用PD-L1特異性scFv(單鏈抗體片段)設計到該公司專有的haNK細胞中以調節抗體依賴性細胞毒性(ADCC)。
NK平臺的獨特優勢,或將改變目前的癌症治療模式
NK細胞的安全性以及它們對廣泛癌症的活性已經在加拿大和歐洲的I期臨床試驗以及美國的多個I期和II期臨床試驗中進行了測試。除了作為一種不需要匹配特定患者的基於細胞的通用療法之外,NK細胞產品主要作為“現成的”活體藥物使用。haNK和t-haNK平臺或許能解決CAR-T細胞治療的某些局限性,降低嚴重細胞因數風暴和長期嚴重不良事件的風險。在晚期癌症患者的I期和II期臨床試驗中,至今,NK細胞安全地進行輸注超過500次,每次輸注劑量為20億個細胞。
參考出處:
https://www.biospace.com/article/releases/nantkwest-launches-first-in-class-first-in-human-phase-i-clinical-trial-with-a-targeted-pd-l1-t-hank-cell-therapy-in-patients-with-solid-tumors/
日本最新細胞療法技術 免疫藥物結合細胞是趨勢

過去,台灣還未開放細胞療法時,日本是台灣人接受細胞療法的主要國家,曾經赴日進行細胞療法的台灣病患,每年少說也有上百人。
「其實,日本研究癌症免疫治療已經有將近五十年的歷史。」二○一八年九月底,日本癌症學會在大阪舉辦了一場講述最新癌症免疫治療的市民講座,日本山口大學醫學系免疫學科、投入研究CAR-T療法的玉田耕治教授,分析了日本癌症免疫治療的發展。
他的研究發展,主要可分為「促進免疫的活化」及「解除免疫抑制」兩個階段。
促進免疫活化抗癌療法
一九七○年代已在日本萌芽
早在一九七○年代,日本就在研究如何促進免疫的活化,達到抗癌效果。代表性的治療法有丸山疫苗,及由ICVS東京診所的蓮見賢一郎醫師的父親、蓮見喜一郎所開發的蓮見疫苗。這類疫苗,主要是以增強免疫力為主,目前偏向於癌症術後保養及癌症預防的應用。
接著一九八○年代開始發展的「養子療法」:抽取免疫細胞後,於體外培育再植入體內,也就是我們俗稱的免疫細胞療法,包括CAR-T都是此模式的應用。來到二○○○年後,免疫療法出現突破,以能解除免疫抑制的免疫檢查點抑制劑及改造免疫細胞基因的CAR-T治療為主。
何謂免疫抑制?簡單來說,研究發現人體的免疫細胞具有一個「檢查點」的機制,而癌細胞之所以能夠不斷增生,是因為它帶著一種抑制訊號,讓免疫細胞「煞車」,取消攻擊。如何打開細胞間的抑制訊號,就成了近年相關研究的關鍵。
然而究竟哪一個療法最有效?答案是「因人而異」,即使是目前經過美國食品藥物管理局(FDA)認證的免疫藥物治療,治癒率也在兩成之譜。不過,蓮見賢一郎進一步分析,免疫細胞療法不一定對每個人都有成效,但一旦有效,效果會非常顯著,所以才會產生所謂「免疫風暴」的副作用。
免疫療法在日本發展得早,療法十分多元,技術也不斷推陳出新。單就免疫細胞療法來說,日本主要可分為三種派系:自體細胞療法、胜肽疫苗療法及免疫藥物併用療法。
自體細胞療法
適用頭頸部癌症
日本千葉大學研究發現,在淋巴球中只占○.一%以下的NKT細胞(自然殺手T細胞),有顯著抗癌功效,因而開發出NKT免疫細胞療法。
千葉大學發現,NKT細胞不只能直接殺死癌細胞,還可以提高其他淋巴球的活性,一起抗癌。該療法主要是抽血培育珍貴的NKT細胞後,再打回病患體內,適用於頭頸癌的治療。
頭頸癌包含口腔癌、咽喉癌、鼻腔癌等好發於頭頸部的癌症。由於此部位靠近五官、頭部等重要器官,手術及放療的副作用較大,比較起來,NKT免疫細胞療法幾乎沒有傷害,也能減輕患者負擔。此治療目前為臨床實驗階段,不接受外籍病患。
位於日本石川縣的金澤大學附屬先進醫學中心,正在研究如何以細胞治療取代傳統化、放療。
現年七十一歲的阿部桂也先生,六年前遭診斷出肺癌一期。由於腫瘤部位較深,靠近脊椎,手術切除腫瘤後,先進醫學中心建議他捨棄傳統的化療,改以免疫細胞療法進行後續的癌症預防治療。之後,阿部桂也每三個月進行一次自體淋巴球活化療法,至今未復發。
金澤大學附屬先進醫學中心還發現,免疫細胞療法對高齡癌症患者化療、放療帶來的副作用有舒緩的效果,合併治療效果非常好。

胜肽疫苗
避免正常細胞受攻擊
除了直接植入免疫細胞,日本久留米大學癌症研究中心開發出利用胜肽抗原誘導免疫細胞發動攻擊的治療方式。
就像是疫苗接種,久留米癌症中心利用胜肽合成癌細胞的蛋白質抗原,再投入體內誘發T細胞出來攻擊。如此一來,也可以避免正常細胞受到攻擊,是副作用非常小的癌症治療法。
目前已經能夠合成出超過兩百種癌細胞抗原。
「那個時候一切都來得好快!」現年五十七歲的李錦豐先生,一三年五月發現罹患腎臟癌,切除腎臟後,同年八月發現肺癌,左右肺葉都有腫瘤。動了兩次手術後,無法再繼續動刀,轉用標靶藥治療,但標靶藥不見成效,腫瘤仍不斷長大。「那時候我能找的方法都找了。」李錦豐鑽研各種先進醫療,最後在同為癌友、台灣癌症免疫細胞協會理事長紀君霖丈夫卡斯柏的介紹下,到久留米醫院接受胜肽疫苗治療。才治療第二個月,腫瘤就停止生長,半年後,腫瘤完全消失。目前,李錦豐每隔十周赴日接受治療,腫瘤至今未復發。他表示,這個治療仍屬臨床研究階段,目前已不收外籍病患。

▲ 6年前同時罹患腎臟癌與肺癌的李錦豐,
至今仍每3個月赴日進行治療,
目前病況控制良好,沒有再復發。(圖片攝影/吳東岳)
併用療法
結合化、放療與免疫藥物
免疫細胞療法原理,看似簡單,就是將免疫細胞取出,培養增殖後放回體內。然而要增加多少?如何置入?都有學問。
蓮見賢一郎就主張,樹突細胞(DC)要直接打入腫瘤,「打入血液裡一定沒有效!」他提醒。
此外,該如何讓樹突細胞認識癌細胞也是關鍵,千葉大學是將NKT與癌細胞在體外配對之後,再植入體內;蓮見賢一郎則是標榜植入樹突細胞後,再接受放療催化細胞認知。
可以確定的是,目前日本免疫細胞療法走向多重治療併用的趨勢。
日本瀨田診所最近就開始了免疫細胞療法配合免疫檢查點抑制劑的臨床安全性實驗,蓮見賢一郎也表示,由於免疫檢查點抑制劑的副作用較大,因此多用於治療計畫中的最後階段,且投藥前的染色體配對試驗也相當重要。
免疫細胞療法在日本也是自費醫療。關於台灣的免疫細胞療法如何定價才合理,大家都十分關心。
曾在日本接受免疫細胞療法的Mr.J表示,金額應交給市場決定,「細胞培育實驗室的器材是需要一定成本的,台灣發展免疫細胞療法已經慢一步了!」
「不能讓漫天喊價造成一個家庭負債累累,為了救一個人的命要毀了一個家庭嗎?」紀君霖也呼籲,癌症病友的負擔已經很大了,政府一定要嚴格把關,不要讓癌友的最後希望被不肖業者利用。
文章摘自:今周刊
https://www.businesstoday.com.tw/article/category/80392/post/201905020037/日本最新細胞療法技術%20免疫藥物結合細胞是趨勢
