TCR-T療法能“治癒”腫瘤
2024年08月06日 18:01 北京
約520萬人民幣一針的TCR-T療法究竟是何方神聖?真的能治癒腫瘤嗎?
近期,全球首款實體瘤TCR-T療法上市的新聞在病友圈中刷屏,給世界各地的癌症患者帶來全新的選擇。然而,目前美國這款一次性細胞治療的標價為 727,000 美元(約520萬人民幣)堪稱“天價”,成為暨120萬一針的CAR-T, 370萬一針的TIL之後,目前最昂貴的癌症免疫療法!
全球首款TCR-T療法震撼上市,開啟實體瘤治療新紀元!
2024年8月2日,美國FDA傳來喜訊,用於治療晚期滑膜肉瘤的TCR-T 細胞療法 afamitresgene autoleucel (afami-cel) 正式獲批上市,同時也有了自己響噹噹的大名–TECELRA®,這是全球首款針對於實體腫瘤的TCR-T療法,也是10多年來滑膜肉瘤迎來的第一個全新治療選擇,將為實體瘤開創治療新紀元,具有里程碑式的意義。
- 獲批用於治療患有不可切除或轉移性滑膜肉瘤的成年患者,這些患者接受過既往化療;HLA-A*02:01P、-A*02:02P、-A*02:03P 或 -A*02:06P 呈陽性;並且其腫瘤表達 MAGE-A4。
- TECELRA 是十多年來首個針對滑膜肉瘤患者的新治療選擇!

滑膜肉瘤是一種極其罕見的惡性腫瘤,在骨骼和軟組織(包括脂肪、肌肉、神經和血管)中發展,患病的通常為年輕人,占所有軟組織肉瘤的 5% 至 10%。幾十年來,滑膜肉瘤患者的治療選擇一直很有限。目前五年生存率低至 36%,而對於診斷時已轉移的患者,生存率低至 20%。
Tecelra 是首個進入市場的 TCR-T 療法,也是十多年來首個針對滑膜肉瘤的新療法。
臨床資料顯示: 對44名滑膜肉瘤患者進行了研究,其中 afami-cel的總體反應率為 43%,其中 4.5% 的患者癌症消失。此外,中位總生存期 (OS) 約為 17 個月;對於有緩解的患者,預計 2 年 總生存率(OS)為 70%,這意味著,70%的患者生存時間超過了2年,這對於既往無藥可用的難治性肉瘤患者是巨大的生存突破。
抗癌新利器!TCR-T療法的三大優勢TCR-T療法之所以備受期待,上市後引起全球轟動,開啟實體瘤治療新紀元,主要是因為以下三點:
1.擴增數量高達數十至上百億的“活的”細胞療法。與CAR-T療法不同,TECELRA 是通過收集患者自己的 T 細胞,並對其進行改造使其具有改良的 TCR 而製成的。這些 TCR 具有增強的識別一種名為 MAGE-A4 的蛋白質的能力,這種蛋白質在滑膜肉瘤等一些癌細胞表面高表達。一旦經過改造並擴增到數十至上百億級別,具有增強 TCR 的 T 細胞就會通過一次性治療放回您的體內,精准識別並瘋狂攻擊表達 MAGE-A4 蛋白的滑膜肉瘤細胞。
2.腫瘤縮小甚至消失,有望治療多種實體瘤除了滑膜肉瘤,這款療法的1期試驗的研究結果在去年1月9日登上了頂級期刊《自然·醫學》(Nature medicine)上,引起轟動。這是首個在人體中進行的研究,共有38名平均接受過3種全身治療失敗,臨床上可以說是沒有任何標準治療方案的極晚期患者接受了新型的TCR-T療法,包括惡性程度極高的滑膜肉瘤,卵巢癌,頭頸癌,胃癌,粘液樣/圓形細胞脂肪肉瘤,非小細胞肺癌,尿路上皮癌,食道癌和黑色素瘤。這些患者在接受afami-cel細胞治療後,產生了強烈的響應。我們分享一些鼓舞人心的案例:
晚期滑膜肉瘤(一)
接受TCR-T治療後,肺部的轉移病灶顯著消退勞力性呼吸困難症狀也明顯改善。
晚期滑膜肉瘤完全緩解(二)
僅接受6周治療,胸膜的巨大轉移病灶就全部消失,達到了完全緩解(CR)。
頭頸癌患者腫瘤大幅消退(三)
僅4周,腫瘤快速消退,達到部分緩解!
3.“一針”即可清除腫瘤。與 CAR-T 和TIL一樣,TCR-T 療法是一種一次性治療。
步驟1 :血液和腫瘤組織檢測,確認HLA類型和MAGE-A4陽性
步驟2 :T細胞採集,這些細胞將用於製造 TECELRA。
步驟3 :治療前化療(4 天),您將接受淋巴細胞清除術。步驟4 :TECELRA 給藥(1 個輸液袋最長 1 小時)步驟5 :輸注後監測(最長 4 周)
2024年6月ASCO年會上公佈了TAEST16001的II期臨床試驗資料,最佳緩解率(ORR)為50%(4/8),中位無進展生存期(mPFS)為5.9個月。

02第四代TCR療法BRL03研發成功,適用於肺癌,胃癌等多種實體瘤
03針對HBV感染肝細胞癌的TCR-T療法問世
LioCyx-M是來恩生物研發的一種專門針對乙型肝炎病毒的特異性 T 細胞療法。這是一種通過轉染編碼 HBV 抗原特異性 TCR 的 mRNA 的自體 T 細胞療法,經過改造的T細胞能夠精准識別殺傷表達 HBV 的腫瘤細胞,已在臨床實驗中用於治療 HBV 相關肝癌和肝移植後復發性 HBV 相關肝癌。“在兩名肝移植患者身上成功進行了 20 多次 T 細胞輸注,沒有一名患者出現與治療相關的不良反應,其中一名患者的肝癌遠處轉移瘤的腫瘤大小減小!”Thinesh Lee Krishnamoorthy博士說。LioCyx-M在1 期研究 (NCT03899415)中用於治療不可切除的乙型肝炎病毒 (HBV) 相關的肝細胞癌 (HCC)的卓越臨床資料在2021年最佳肝癌峰會上震撼全場!
截至 2020 年 4 月 30 日,共8 名沒有治癒性治療選擇的不可切除的 HBV 相關肝細胞癌 (HCC) 患者接受了LioCyx-M療法。結果顯示,在可評估的 7 名患者中,3 名患者病情穩定,其中1名患者肝臟腫瘤的大小顯著減少30%以上,並維持了30個月!
2021年12月,FDA授予乙型肝炎病毒 (HBV) 相關肝細胞癌 (HCC) 患者的潛在一流療法 LioCyx-M004快速通道指定!有望加快在全球的上市步伐,我們期待這一顯著改善 HBV相關肝細胞癌預後的創新療法早日獲批上市,造福更多患者。
申請國研TCR-T療法
除了上面介紹的TCR-T療法,目前國內有包括香雪生物,百吉生物、來恩生物、華夏英泰、可瑞生物、天科雅、普瑞金、深圳賓德、泛恩生物、立淩生物等17家生物公司佈局TCR-T賽道,其中50多個TCR-T在研項目已進入或者獲批臨床。其中,香雪生命科學的TAEST16001注射液是國內進度最快的產品之一,已進入II期臨床階段。此外,進度較快的還有華夏英泰的YT-E001,正在開展治療Epstein-Barr病毒(EBV)相關鼻咽癌的 II期臨床。
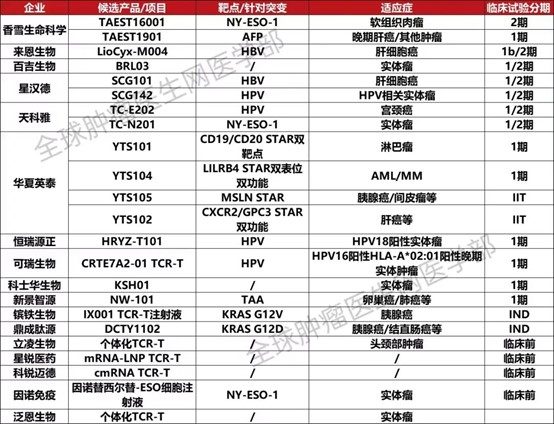
好消息是,目前SCG101,142,TC-E202,N201,YTS102等針對肝癌,宮頸癌,胰腺癌,結直腸癌等各類實體瘤的臨床試驗正在進行中,很多患者已通過全球腫瘤醫生網成功入組。
部分入組條件
18-75歲,男女不限,無嚴重基礎疾病;
- 僅患一種惡性實體腫瘤,肝癌、頭頸部鱗癌、宮頸癌、胰腺癌等實體瘤;
- 經標準治療失敗或缺乏有效治療方法;
- 各項檢查符合要求且至少1年的預期壽命。
想尋求TCR-T療法及其他國內外新抗癌治療幫助,且經濟條件允許的情況下,可以先將病歷提交至全球腫瘤醫生網醫學部(400-666-7998)進行初步評估,一旦審核通過,有機會獲得”天價“療法免費治療的機會。
隨著全球首款TCR-T細胞療法的成功上市和國內企業的不斷努力,全球範圍內TCR-T細胞療法領域有望迎來爆發式增長。預計在未來幾年內,將有更多TCR-T細胞療法產品獲批上市,為患者提供更多樣化、更精准的治療選擇。
越來越多的醫生將有能力讓合適的患者在正確的時間獲得個體化”量體裁衣“式的治療方案!相信這些效果好的抗癌療法都會加快在我國上市和納入醫保的步伐,讓更多的百姓獲益,我們共同期待!隨著更多治療方案的發展,晚期腫瘤患者將迎來更多治療選擇和希望,我們期待人類攻克癌症的那一天早日到來。
參考資料:
https://www.fiercepharma.com/pharma/adaptimmune-scores-fda-nod-first-engineered-cell-therapy-solid-tumorhttps://ascopubs.org/doi/10.1200/JCO.2024.42.16_suppl.11548https://www.onclive.com/view/fda-grants-accelerated-approval-to
