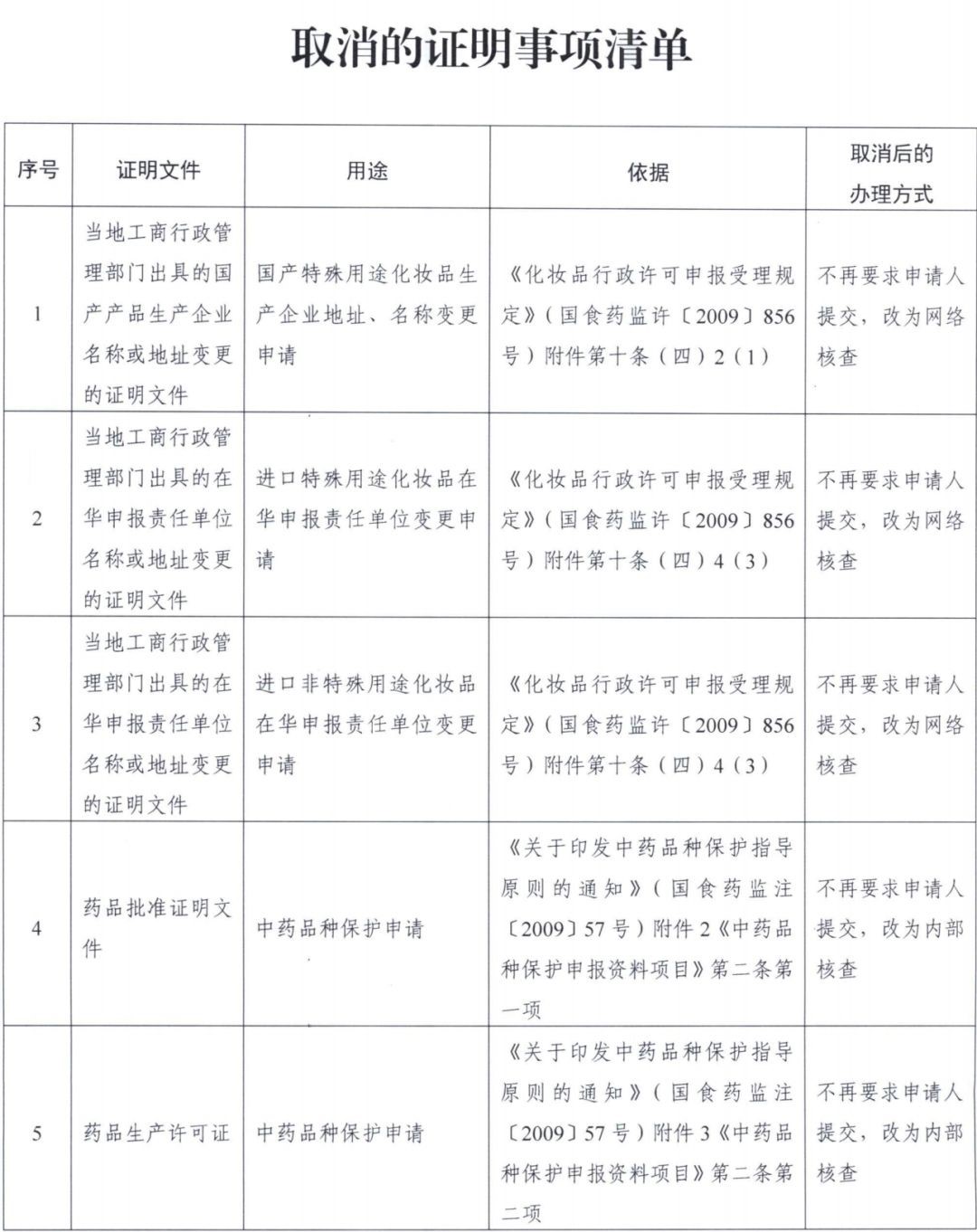
新舊《中國藥品管理法》完整對比
2019年4月26日,第十三屆全國人大常委會第十次會議對《中華人民共和國藥品管理法(修訂草案)》進行了審議。中國人大網公佈了《中華人民共和國藥品管理法(修訂草案)》,社會公眾可以直接登錄中國人大網(www.npc.gov.cn)提出意見,也可以將意見寄送全國人大常委會法制工作委員會(北京市西城區前門西大街1號,郵編:100805。信封上請注明藥品管理法修訂草案徵求意見)。徵求意見截止日期:2019年5月25日。
文章內容紅色字體為新增或修改的內容,藍色字體的含刪除線的為已刪除的內容。
《中華人民共和國藥品管理法(修訂草案)》章節按照藥品研製與註冊、藥品生產、藥品經營、藥劑管理、上市後管理等環節調整結構。
第一章 總則
第一條 為加強藥品監督管理,保證藥品品質,保障人體用藥安全,維護人民身體健康和用藥的合法權益,特制定本法。
第二條 在中華人民共和國境內從事藥品的研製、生產、經營、使用和監督管理的單位或者個人活動,必須遵守適用本法。
第三條 藥品管理應當以人民健康為中心,建立科學、嚴格的監督管理制度,全面提升藥品品質,保障用藥安全、有效、可及。
第四條 國家發展現代藥和傳統藥,充分發揮其在預防、醫療和保健中的作用。國家保護野生藥材資源和中藥品種,鼓勵培育道地中藥材。
第五條 國家鼓勵研究和創制新藥,保護公民、法人和其他組織研究、開發新藥的合法權益。
第六條 國家對藥品管理實行藥品上市許可持有人制度。藥品上市許可持有人應當保證藥品安全、有效,對藥品研製、生產、經營、使用全過程依法承擔責任。
第七條 從事藥品研製、生產、經營、使用活動,應當遵守法律、法規、標準和規範,保證全過程資料真實、準確、完整和可追溯。
第八條 國務院藥品監督管理部門主管全國藥品監督管理工作。國務院有關部門在各自的職責範圍內負責與藥品有關的監督管理工作。國務院藥品監督管理部門應當配合國務院經濟綜合主管有關部門,執行國家制定的藥品行業發展規劃和產業政策。
省、自治區、直轄市人民政府藥品監督管理部門負責本行政區域內的藥品監督管理工作。省、自治區、直轄市人民政府有關部門在各自的職責範圍內負責與藥品有關的監督管理工作。設區的市級、縣級人民政府承擔藥品監督管理職責的部門負責本行政區域內的藥品監督管理工作。縣級以上地方人民政府有關部門在各自的職責範圍內負責與藥品有關的監督管理工作。
第九條 縣級以上地方人民政府對本行政區域內的藥品監督管理工作負責,統一領導、組織、協調本行政區域內的藥品監督管理工作以及藥品安全突發事件應對工作,建立健全藥品監督管理工作機制和資訊共用機制。
第十條 縣級以上人民政府應當將藥品安全工作列入本級國民經濟和社會發展規劃,將藥品安全工作經費納入本級政府預算,加強藥品監督管理能力建設,為藥品安全工作提供保障。(新增)
第十一條 藥品監督管理部門設置或者確指定的藥品檢驗專業技術機構,承擔依法實施藥品審批和藥品品質監督管理檢查所需的藥品審評、檢驗、核查、監測與評價工作。
第十二條 各級人民政府應當加強藥品安全宣傳教育,開展藥品安全法律、法規等知識的普及工作。
新聞媒體應當開展藥品安全法律、法規等知識的公益宣傳,並對藥品違法行為進行輿論監督。有關藥品的宣傳報導應當全面、科學、客觀、公正。
第十三條 藥品行業協會應當加強行業自律,建立健全行業規範,推動行業誠信體系建設,引導和督促企業依法開展藥品生產經營等活動。
第十四條 縣級以上人民政府及其有關部門對在藥品研製、生產、經營、使用和監督管理活動中做出重大貢獻的單位和個人,按照國家有關規定給予表彰、獎勵。)
第二章 藥品研發和註冊
第十五條 國家支援以臨床價值為導向、對人體疾病具有明確或者特殊療效的藥物創新,鼓勵具有新的治療機理、對人體具有多靶向系統性調節干預功能等的新藥研製,推動藥品技術進步。
第十六條 研製新藥,必須按照國務院藥品監督管理部門的規定如實報送研製方法、品質指標、藥理及毒理試驗結果等有關資料和樣品以及倫理審查意見,經國務院藥品監督管理部門批准後,方可進行臨床試驗。國務院藥品監督管理部門應當自受理臨床試驗申請之日起六十個工作日內決定是否同意並通知申請人,逾期未通知的,視為同意。
開展藥物臨床試驗,應當在具備相應條件的臨床試驗機構進行。藥物臨床試驗機構實行備案管理,具體辦法由國務院藥品監督管理部門、國務院衛生健康主管部門共同制定。
藥物臨床試驗機構資格的認定辦法,由國務院藥品監督管理部門、國務院衛生行政部門共同制定。完成臨床試驗並通過審批的新藥,由國務院藥品監督管理部門批准,發給新藥證書。
第十七條 藥物的非臨床安全性評價研究機構和藥物臨床試驗機構從事藥品研製活動,必須分別執行遵守藥物非臨床研究品質管制規範、藥物臨床試驗品質管制規範,保證藥品研製過程持續符合法定要求。
藥物非臨床研究品質管制規範、藥物臨床試驗品質管制規範由國務院確定的藥品監督管理部門商國務院有關部門制定。
第十八條 開展藥物臨床試驗,應當符合倫理原則。
藥物臨床試驗機構應當成立倫理委員會,負責審查臨床試驗方案,監督規範開展臨床試驗,保障受試者合法權益。倫理委員會應當建立倫理審查工作制度、操作規程,保證倫理審查過程獨立、客觀、公正。
第十九條 開展藥物臨床試驗,應當向受試者或者其監護人如實說明和解釋臨床試驗的有關情況和風險,取得受試者或者其監護人自願簽署的知情同意書,並採取有效措施保護受試者的合法權益。
第二十條 對正在開展臨床試驗的用於治療嚴重危及生命且尚無有效治療手段的疾病的藥物,經醫學觀察可能獲益,並且符合倫理原則的,經審查、知情同意後可以在開展臨床試驗的機構內免費用於其他病情相同的患者,將其納入受試者範圍。
第二十一條 生產新藥或者已有國家標準的藥品的在中國境內上市的藥品,須經國務院藥品監督管理部門批准,並發給藥品批准文號取得藥品註冊證書;但是,生產沒有批准文號未實施審批管理的中藥材和中藥飲片除外。實施批准文號審批管理的中藥材、中藥飲片品種目錄由國務院藥品監督管理部門會同國務院中醫藥管理部門制定。
藥品生產企業在取得藥品批准文號後,方可生產該藥品。申請藥品註冊,應當提供真實、充分、可靠的研究資料、資料和樣品,證明藥品的安全性、有效性和品質可控性。
第二十二條 對申請註冊的藥品,國務院藥品監督管理部門應當組織藥學、醫學和其他技術人員進行審評,對藥品的安全性、有效性以及申請人保障藥品安全性、有效性的品質管制、風險防控和責任賠償等能力進行審查;符合條件的,發給藥品註冊證書。(新增)國務院藥品監督管理部門對直接接觸藥品的包裝材料和容器一併審批。
第二十三條 對治療嚴重危及生命且尚無有效治療手段的疾病以及公共衛生方面急需的藥物,中期臨床試驗已有資料顯示療效並能預測其臨床價值的,可以附條件批准,並在藥品註冊證書中載明相關事項。(新增)
第二十四條 藥品必須符合國家藥品標準。中藥飲片依照本法第十條第二款的規定執行。國務院藥品監督管理部門頒佈的《中華人民共和國藥典》和藥品標準為國家藥品標準。
國務院藥品監督管理部門合同國務院衛生健康主管部門組織藥典委員會,負責國家藥品標準的制定和修訂。國務院藥品監督管理部門設置或指定的藥品檢驗機構負責標定國家藥品標準品、對照品。
第二十五條 列入國家藥品標準的藥品名稱為藥品通用名稱。已經作為藥品通用名稱的,該名稱不得作為藥品商標使用。
第三章 藥品上市許可持有人
第二十六條 取得藥品註冊證書的,為藥品上市許可持有人。藥品上市許可持有人應當遵守本法規定,對藥品的非臨床研究、臨床試驗、生產經營、上市後研究、不良反應監測及報告與處理等承擔責任。藥品上市許可持有人的法定代表人、主要負責人對藥品品質全面負責。
第二十七條 藥品上市許可持有人應當建立藥品品質保證體系,配備品質負責人獨立負責藥品品質管制。藥品上市許可持有人應當對受託生產企業、經營企業的品質管制體系進行定期審核,保證其持續具備品質保證和控制能力。
第二十八條 藥品上市許可持有人可以自行生產藥品,也可以委託藥品生產企業生產。
藥品上市許可持有人自行生產藥品的,應當依照本法規定取得藥品生產許可證;委託生產的,應當委託符合條件的藥品生產企業,並與其簽訂委託協定和品質協定。藥品上市許可持有人和受託生產企業應當嚴格履行協議約定的義務。
國務院藥品監督管理部門制定藥品委託生產品質協定指南,指導、監督藥品上市許可持有人和受託生產企業履行藥品品質保證義務。
疫苗、血液製品、麻醉藥品、精神藥品、醫療用毒性藥品不得委託生產;但是,國務院藥品監督管理部門另有規定的除外。
第二十九條 藥品上市許可持有人必須對藥品進行品質檢驗、審核。不符合國家藥品標準的,不得銷售。
藥品上市許可持有人應當建立藥品上市放行規程,對藥品生產企業出廠放行的藥品進行審核,經品質負責人簽字後方可放行。
第三十條 藥品上市許可持有人可以自行經營藥品,也可以委託藥品經營企業經營。
藥品上市許可持有人自行經營藥品的,應當具備本法規定的條件;委託經營的,應當委託符合條件的藥品經營企業,並與其簽訂委託協定。藥品上市許可持有人和受託經營企業應當嚴格履行協議約定的義務。
第三十一條 藥品上市許可持有人、藥品生產企業、藥品經營企業委託儲存、運輸藥品的,應當對受託方的品質保障能力和風險管理能力進行評估,與其簽訂委託協議,明確藥品品質責任、操作規程等內容,並對受託方進行監督。
第三十二條 藥品上市許可持有人、藥品生產企業、藥品經營企業和醫療機構應當建立並實施藥品品質追溯制度,保證藥品可追溯。
第三十三條 藥品上市許可持有人應當建立年度報告制度,每年將藥品生產銷售、上市後研究、風險管理等情況按照規定向省、自治區、直轄市人民政府藥品監督管理部門報告。
第三十四條 藥品上市許可持有人為境外企業的,應當由其在中國境內設立的代表機構或者指定的企業法人履行藥品上市許可持有人義務,共同承擔藥品上市許可持有人責任。
第三十五條 中藥飲片生產企業履行藥品上市許可持有人的相關義務,對中藥飲片的生產、銷售、不良反應報告等負責;建立中藥飲片品質追溯體系,對中藥飲片生產、銷售實行全過程管理,保證中藥飲片安全、有效、可追溯。
第三十六條 經國務院藥品監督管理部門批准,藥品上市許可持有人可以轉讓藥品註冊證書。藥品註冊證書的受讓方應當具備保障藥品安全性、有效性的品質管制、風險防控和責任賠償等能力,依法全面履行藥品上市許可持有人義務。
第三十三條 國務院藥品監督管理部門組織藥學、醫學和其他技術人員,對新藥進行審評,對已經批准生產的藥品進行再評價。
第四章 藥品生產
第三十七條 開辦藥品生產企業,須經企業所在地省、自治區、直轄市人民政府藥品監督管理部門批准並發給《藥品生產許可證》。無《藥品生產許可證》的,不得生產藥品。
《藥品生產許可證》應當標明有效期和生產範圍,到期重新審查發證。
藥品監督管理部門批准開辦藥品生產企業,除依據本法第三十八條規定的條件外,還應當符合國家制定的藥品行業發展規劃和產業政策,防止重複建設。
第三十八條 開辦藥品生產企業,必須具備以下條件:
(一)具有依法經過資格認定的藥學技術人員、工程技術人員及相應的技術工人;
(二)具有與其藥品生產相適應的廠房、設施和衛生環境;
(三)具有能對所生產藥品進行品質管制和品質檢驗的機構、人員以及必要的儀器設備;
(四)具有保證藥品品質的規章制度,並符合國務院藥品監督管理部門依據本法制定的藥品生產品質管制規範要求。
第三十九條 從事藥品生產活動,必須遵守藥品生產品質管制規範,建立健全藥品生產品質管制體系,保證藥品生產全過程持續符合法定要求。
藥品生產企業的法定代表人、主要負責人對本企業的藥品生產活動全面負責。
藥品生產企業必須按照國務院藥品監督管理部門依據本法制定的《藥品生產品質管制規範》組織生產。藥品監督管理部門按照規定對藥品生產企業是否符合《藥品生產品質管制規範》的要求進行認證;對認證合格的,發給認證證書。《藥品生產品質管制規範》的具體實施辦法、實施步驟由國務院藥品監督管理部門規定。
第四十條 除中藥飲片的炮製外,藥品必須按照國家藥品標準和國務院藥品監督管理部門批准的生產工藝進行生產,生產記錄必須完整準確。藥品生產企業改變影響藥品品質的生產工藝的,必須報原批准部門審核批准。
中藥飲片必須按照國家藥品標準炮製;國家藥品標準沒有規定的,必須按照省、自治區、直轄市人民政府藥品監督管理部門制定的炮製規範炮製。省、自治區、直轄市人民政府藥品監督管理部門制定的炮製規範應當報國務院藥品監督管理部門備案。不符合國家藥品標準或者不按照省、自治區、直轄市人民政府藥品監督管理部門制定的炮製規範炮製的,不得出廠、銷售。
第四十一條 對藥品生產過程中的變更,按照其對藥品安全性、有效性和品質可控性可能發生的風險和產生影響的程度,實行分類管理。屬於重大變更的,應當報國務院藥品監督管理部門審批,其他變更應當按照國務院藥品監督管理部門的規定備案或者報告。
藥品上市許可持有人應當按照國務院藥品監督管理部門的規定,全面評估、驗證變更事項對藥品安全性、有效性和品質可控性的影響。
第四十二條 生產藥品所需的原料、輔料,必須符合藥用要求。生產藥品,應當按照規定對供應原料、輔料等的供應商進行審核,保證購進、使用的原料、輔料等符合前款規定要求。
第四十三條 藥品生產企業必須對其生產的藥品進行品質檢驗;不符合國家藥品標準或者不按照省、自治區、直轄市人民政府藥品監督管理部門制定的中藥飲片炮製規範炮製的,不得出廠。藥品生產企業應當建立藥品出廠放行規程,明確出廠放行的標準、條件。符合標準、條件的,經品質負責人簽字後方可放行。
第四十四條 藥品上市許可持有人、藥品生產企業、藥品經營企業和醫療機構直接接觸藥品的工作人員,必須每年進行健康檢查。患有傳染病或者其他可能污染藥品的疾病的,不得從事直接接觸藥品的工作。
第四十五條 直接接觸藥品的包裝材料和容器,必須符合藥用要求,符合保障人體健康、安全的標準。藥品生產企業不得使用未經批准的直接接觸藥品的包裝材料和容器。
對不合格的直接接觸藥品的包裝材料和容器,由藥品監督管理部門責令停止使用。
第四十六條 藥品包裝必須適合藥品品質的要求,方便儲存、運輸和醫療使用。發運中藥材必須有包裝。在每件包裝上,必須注明品名、產地、日期、調出單位,並附有品質合格的標誌。
第四十七條 藥品包裝必須按照規定印有或者貼有標籤並附有說明書。
標籤或者說明書上必須注明藥品的通用名稱、成份、規格、上市許可持有人、生產企業及其位址、批准文號、產品批號、生產日期、有效期、適應症或者功能主治、用法、用量、禁忌、不良反應和注意事項。
麻醉藥品、精神藥品、醫療用毒性藥品、放射性藥品、外用藥品和非處方藥的標籤,必須印有規定的標誌。
第十三條 經省、自治區、直轄市人民政府藥品監督管理部門批准,藥品生產企業可以接受委託生產藥品。
第五章 藥品經營
第四十八條 開辦藥品批發企業,須經企業所在地省、自治區、直轄市人民政府藥品監督管理部門批准並發給《藥品經營許可證》;開辦藥品零售企業,須經企業所在地縣級以上地方人民政府承擔藥品監督管理職責的部門批准並發給《藥品經營許可證》。無《藥品經營許可證》的,不得經營藥品。
《藥品經營許可證》應當標明有效期和經營範圍,到期重新審查發證。
藥品監督管理部門批准開辦藥品經營企業,除依據本法第四十九條規定的條件外,還應當遵循合理佈局和方便群眾購藥的原則。
第四十九條 開辦藥品經營企業必須具備以下條件:
(一)具有依法經過資格認定的藥學技術人員;
(二)具有與所經營藥品相適應的營業場所、設備、倉儲設施、衛生環境;
(三)具有與所經營藥品相適應的品質管制機構或者人員;
(四)具有保證所經營藥品品質的規章制度,並符合國務院藥品監督管理部門依據本法制定的藥品經營品質管制規範要求。
第五十條 藥品經營企業必須按照國務院藥品監督管理部門依據本法制定的《藥品經營品質管制規範》經營藥品。藥品監督管理部門按照規定對藥品經營企業是否符合《藥品經營品質管制規範》的要求進行認證;對認證合格的,發給認證證書。
《藥品經營品質管制規範》的具體實施辦法、實施步驟由國務院藥品監督管理部門規定。
從事藥品經營活動,必須符合藥品經營品質管制規範,建立健全藥品經營品質管制體系,保證藥品經營全過程持續符合法定要求。
藥品經營企業的法定代表人、主要負責人對本企業的藥品經營活動全面負責。
第五十一條 國家對藥品實行處方藥與非處方藥分類管理制度。具體辦法由國務院制定。
第五十二條 藥品上市許可持有人、藥品生產企業、藥品經營企業和醫療機構必須從藥品上市許可持有人或者具有藥品生產、經營資格的企業購進藥品;但是,購進沒有實施批准文號管理未實施審批管理的中藥材除外。
第五十三條 藥品經營企業購進藥品,必須建立並執行進貨檢查驗收制度,驗明藥品合格證明和其他標識;不符合規定要求的,不得購進。
第五十四條 藥品經營企業購銷藥品,必須有真實完整的購銷記錄。購銷記錄必須注明藥品的通用名稱、劑型、規格、批號、有效期、上市許可持有人、生產廠商、購(銷)貨單位、購(銷)貨數量、購銷價格、購(銷)貨日期及國務院藥品監督管理部門規定的其他內容。
第五十五條 藥品經營企業銷售藥品必須準確無誤,並正確說明用法、用量和注意事項;調配處方必須經過核對,對處方所列藥品不得擅自更改或者代用。對有配伍禁忌或者超劑量的處方,應當拒絕調配;必要時,經處方醫師更正或者重新簽字,方可調配。藥品經營企業銷售中藥材,必須標明產地。
第五十六條 藥品經營企業必須制定和執行藥品保管制度,採取必要的冷藏、防凍、防潮、防蟲、防鼠等措施,保證藥品品質。藥品入庫和出庫必須執行檢查制度。
第五十七條 城鄉集市貿易市場可以出售中藥材,國務院另有規定的除外。
城鄉集市貿易市場不得出售中藥材以外的藥品,但持有《藥品經營許可證》的藥品零售企業在規定的範圍內可以在城鄉集市貿易市場設點出售中藥材以外的藥品。具體辦法由國務院規定。
第五十八條 藥品網路銷售協力廠商平臺提供者應當按照國務院藥品監督管理部門的規定,向所在地省、自治區、直轄市人民政府藥品監督管理部門備案。
協力廠商平臺提供者應當對申請進入平臺經營的藥品上市許可持有人、藥品經營企業資質進行審查,確保進入平臺經營的藥品上市許可持有人、藥品經營企業符合法定要求,並對發生在平臺的藥品經營行為進行管理。
協力廠商平臺提供者發現進入平臺經營的藥品上市許可持有人、藥品經營企業有違反本法規定行為的,應當及時制止並立即報告所在地縣級人民政府承擔藥品監督管理職責的部門;發現嚴重違法行為的,應當立即停止提供網路銷售平臺服務。
藥品上市許可持有人、藥品經營企業不得通過藥品網路銷售協力廠商平臺直接銷售處方藥。
第五十九條 新發現和從國外引種的藥材,經國務院藥品監督管理部門審核批准後,方可銷售。
第六十條 藥品進口,須經國務院藥品監督管理部門組織審查,經審查確認符合品質標準、安全有效的,方可批准進口,並發給進口藥品註冊證書。
醫療單位機構臨床急需或者個人自用進口的少量藥品,按照國家有關規定辦理進口手續。
第六十一條 藥品必須從允許藥品進口的口岸進口,並由進口藥品的企業向口岸所在地藥品監督管理部門登記備案。海關憑藥品監督管理部門出具的《進口藥品通關單》放行。無《進口藥品通關單》的,海關不得放行。
口岸所在地藥品監督管理部門應當通知藥品檢驗機構按照國務院藥品監督管理部門的規定對進口藥品進行抽查檢驗,並依照本法第四十一條第二款的規定收取檢驗費。
允許藥品進口的口岸由國務院藥品監督管理部門會同海關總署提出,報國務院批准。
第六十二條 進口、出口麻醉藥品和國家規定範圍內的精神藥品,必須持有國務院藥品監督管理部門發給的《進口准許證》、《出口准許證》。
第六十三條 國務院藥品監督管理部門對下列藥品在銷售前或者進口時,應當指定藥品檢驗機構進行檢驗;檢驗不合格的,不得銷售或者進口:
(一)國務院藥品監督管理部門規定的生物製品;
(二)首次在中國銷售的藥品;
(三)國務院規定的其他藥品。
前款所列藥品的檢驗費專案和收費標準由國務院財政部門會同國務院價格主管部門核定並公告。檢驗費收繳辦法由國務院財政部門會同國務院藥品監督管理部門制定。
第六十四條 禁止進口療效不確、不良反應大或者其他原因危害人體健康的藥品。
第六章 醫療機構的藥劑管理
第六十五條 醫療機構必須配備依法經過資格認定的藥學技術人員。非藥學技術人員不得直接從事藥劑技術工作。
第六十六條 醫療機構配製製劑,須經所在地省、自治區、直轄市人民政府衛生行政部門審核同意,由省、自治區、直轄市人民政府藥品監督管理部門批准,並發給《醫療機構製劑許可證》。無《醫療機構製劑許可證》的,不得配製製劑。《醫療機構製劑許可證》應當標明有效期,到期重新審查發證。
第六十七條 醫療機構配製製劑,必須具有能夠保證製劑品質的設施、管理制度、檢驗儀器和衛生條件。
第六十八條 醫療機構配製的製劑,應當是本單位臨床需要而市場上沒有供應的品種,並須經所在地省、自治區、直轄市人民政府藥品監督管理部門批准後方可配製,法律對配製中藥製劑另有規定的除外。配製的製劑必須按照規定進行品質檢驗;合格的,憑醫師處方在本醫療機構使用。特殊情況下,經國務院或者省、自治區、直轄市人民政府的藥品監督管理部門批准,醫療機構配製的製劑可以在指定的醫療機構之間調劑使用。
醫療機構配製的製劑,不得在市場銷售。
第六十九條 醫療機構購進藥品,必須建立並執行進貨檢查驗收制度,驗明藥品合格證明和其他標識;不符合規定要求的,不得購進和使用。
第七十條 醫療機構的藥劑人員調配處方,必須經過核對,對處方所列藥品不得擅自更改或者代用。對有配伍禁忌或者超劑量的處方,應當拒絕調配;必要時,經處方醫師更正或者重新簽字,方可調配。
第七十一條 醫療機構必須制定和執行藥品保管制度,採取必要的冷藏、防凍、防潮、防蟲、防鼠等措施,保證藥品品質。
第三十六條 國家實行中藥品種保護制度。具體辦法由國務院制定。
第七章 藥品上市後管理
第七十二條 藥品上市許可持有人應當制定藥品上市後風險管理計畫,主動開展藥品上市後研究,對藥品安全性、有效性進行進一步確證,加強對已上市藥品的持續管理。
第七十三條 藥品上市許可持有人應當對已上市藥品的安全性、有效性定期開展上市後評價。必要時,國務院藥品監督管理部門可以責令藥品上市許可持有人開展上市後評價。
國務院藥品監督管理部門對已經批准生產或者進口的藥品已上市的藥品,應當組織調查、評價。經評價,對療效不確切、不良反應大或者因其他原因危害人體健康的藥品,應當撤銷批准文號或者進口藥品註冊證書註銷藥品註冊證書。
已被註銷藥品註冊證書的藥品,不得生產或者進口、銷售和使用;已經生產或者進口的,由當地藥品監督管理部門監督銷毀或者處理。
第七十四條 藥品上市許可持有人應當開展藥品上市後不良反應監測,主動收集、跟蹤分析藥品不良反應資訊,對已識別風險的藥品及時採取風險控制措施。
第七十五條 國家實行藥品不良反應報告制度。藥品上市許可持有人、藥品生產企業、藥品經營企業和醫療機構必須經常考察本單位所生產、經營、使用的藥品品質、療效和反應。發現可能與用藥有關的嚴重不良反應,必須及時向當地省、自治區、直轄市人民政府藥品監督管理部門和衛生健康主管部門報告。具體辦法由國務院藥品監督管理部門會同國務院衛生健康主管部門制定。
對已確認發生嚴重不良反應的藥品,國務院或者省、自治區、直轄市人民政府的藥品監督管理部門可以採取停止生產、銷售、使用的緊急控制措施,並應當在五日內組織鑒定,自鑒定結論作出之日起十五日內依法作出行政處理決定。
第七十六條 上市藥品存在品質問題或者其他安全隱患的,藥品上市許可持有人應當立即停止生產、銷售,告知相關生產企業、經營企業和醫療機構停止生產、經營和使用,召回已上市銷售的藥品,及時公開召回資訊,並將藥品召回和處理情況向省、自治區、直轄市人民政府藥品監督管理部門和衛生健康主管部門報告。藥品生產企業、藥品經營企業和醫療機構應當配合。
藥品上市許可持有人依法應當召回藥品而未召回的,省、自治區、直轄市人民政府藥品監督管理部門應當責令其召回。
第七十七條 對附條件批准的藥品,藥品上市許可持有人必須採取相應風險管理措施,並在規定期限內按照要求完成相關研究工作。未按照要求完成研究工作或者不能證明其獲益大於風險的,由國務院藥品監督管理部門註銷其藥品註冊證書。
第八章 藥品價格和廣告
第七十八條 國家對藥品價格進行監測,必要時開展成本價格調查,加強藥品價格監督檢查,依法查處藥品價格違法行為,維護藥品價格秩序。
第七十九條 依法實行市場調節價的藥品,藥品上市許可持有人、藥品生產企業、藥品經營企業和醫療機構應當按照公平、合理和誠實信用、質價相符的原則制定價格,為用藥者提供價格合理的藥品。
藥品上市許可持有人、藥品生產企業、藥品經營企業和醫療機構應當遵守國務院藥品價格主管部門關於藥品價格管理的規定,制定和標明藥品零售價格,禁止暴利和損害用藥者利益的價格欺詐行為。
第八十條 藥品上市許可持有人、藥品生產企業、藥品經營企業和醫療機構應當依法向藥品價格主管部門提供其藥品的實際購銷價格和購銷數量等資料。
第八十一條 醫療機構應當向患者提供所用藥品的價格清單,醫療保險定點醫療機構還應當按照規定如實公佈其常用藥品的價格,加強合理用藥管理。具體辦法由國務院衛生健康主管部門制定。
第八十二條 禁止藥品上市許可持有人、藥品生產企業、藥品經營企業和醫療機構在藥品購銷中賬外暗中給予、收受回扣或者其他利益。
禁止藥品上市許可持有人、藥品生產企業、藥品經營企業或者代理人以任何名義給予使用其藥品的醫療機構的負責人、藥品採購人員、醫師等有關人員財物或者其他利益。禁止醫療機構負責人、藥品採購人員、醫師等有關人員以任何名義收受藥品上市許可持有人、藥品生產企業、藥品經營企業或者代理人給予的財物或者其他利益。
第八十三條 藥品廣告須經企業所在地省、自治區、直轄市人民政府藥品監督管理部門批准,並發給藥品廣告批准文號;未取得藥品廣告批准文號的,不得發佈。
處方藥可以在國務院衛生健康主管部門和國務院藥品監督管理部門共同指定的醫學、藥學專業刊物上介紹,但不得在大眾傳播媒介發佈廣告或者以其他方式進行以公眾為物件的廣告宣傳。
第八十四條 藥品廣告的內容必須真實、合法,以國務院藥品監督管理部門批准的說明書為准,不得含有虛假的內容。
藥品廣告不得含有不科學的表示功效、安全性的斷言或者保證;不得利用國家機關、醫藥科研單位、學術機構或者專家、學者、醫師、患者的名義和形象作證明。
非藥品廣告不得有涉及藥品的宣傳。
第八十五條 市場監督管理部門應當依照廣告管理法律法規的規定,對藥品廣告進行檢查,查處違法行為。
省、自治區、直轄市人民政府藥品監督管理部門應當對其批准的藥品廣告進行檢查,對於違反本法和《中華人民共和國廣告法》的廣告,應當向廣告監督管理機關通報並提出處理建議,廣告監督管理機關應當依法作出處理。
第八十六條 藥品價格和廣告,本法未規定的,適用《中華人民共和國價格法》、《中華人民共和國廣告法》的規定。
第九章 藥品儲備和供應
第八十七條 國家實行藥品儲備制度。國內發生重大災情、疫情及其他突發事件時,國務院規定的部門可以緊急調用企業藥品。依照《中華人民共和國突發事件應對法》的規定,可以緊急調用藥品。
第八十八條 國家建立藥品供求監測體系,及時收集和匯總分析短缺藥品供求資訊,對短缺藥品實行預警,採取應對措施。
第八十九條 國家實行短缺藥品清單管理制度。短缺藥品清單由國務院衛生健康主管部門會同國務院藥品監督管理等部門制定,並適時調整。
藥品上市許可持有人停止生產短缺藥品或者急救藥品的,應當按照規定向省級以上人民政府藥品監督管理部門報告。
第九十條 國家鼓勵短缺藥品的研製和生產,對臨床急需的短缺藥品及原料藥予以優先審評審批。
第九十一條 對國內供應不足的短缺藥品,國務院有權限制或者禁止出口。必要時,國務院有關部門可以採取適當的生產、價格干預和組織進口等措施,保障藥品供應。
第九十二條 藥品上市許可持有人、藥品生產企業、藥品經營企業應當履行社會責任,保障藥品的生產和供應。
第十章 監督管理
第九十三條 禁止生產(包括配製,下同)、銷售假藥。有下列情形之一的,為假藥:
(一)藥品所含成份與國家藥品標準規定的成份不符的;
(二)以非藥品冒充藥品或者以他種藥品冒充此種藥品的。
有下列情形之一的藥品,按假藥論處:
(一)國務院藥品監督管理部門規定禁止使用的;
(二)依照本法必須批准而未經批准生產、進口,或者依照本法必須檢驗而未經檢驗即銷售的;
(三)變質的;
(四)被污染的;
(五)使用依照本法必須取得批准文號而未取得批准文號的批准而未經批准的原料藥生產的;
(六)所標明的適應症或者功能主治超出規定範圍的。
第九十四條 禁止生產、銷售劣藥。
藥品成份的含量不符合國家藥品標準的,為劣藥。
有下列情形之一的藥品,按劣藥論處:
(一)未標明有效期或者更改有效期的;
(二)不注明或者更改生產批號的;
(三)超過有效期的;
(四)直接接觸藥品的包裝材料和容器未經批准的;
(五)擅自添加著色劑、防腐劑、香料、矯味劑及輔料的;
(六)其他不符合藥品標準規定的。
第九十五條 藥品監督管理部門有權按照法律、行政法規的規定對報經其審批的藥品研製和藥品的、生產、經營以及醫療機構使用藥品的事項進行監督檢查,必要時可以對為藥品研製、生產、經營、使用提供產品或者服務的單位和個人進行延伸檢查,有關單位和個人不得拒絕和隱瞞。
藥品監督管理部門應當對生物製品實施重點監督檢查。
對有證據證明可能存在安全隱患的,藥品監督管理部門根據監督檢查情況,應當採取告誡、責任約談、限期整改以及暫停生產、銷售、使用、進口等措施,並及時公佈檢查處理結果。
藥品監督管理部門進行監督檢查時,必須出示證明檔,對監督檢查中知悉的被檢查人的技術秘密和業務商業秘密應當保密。
第九十六條 藥品監督管理部門根據監督檢查的需要,可以對藥品品質進行抽查檢驗。抽查檢驗應當按照規定抽樣,並不得收取任何費用。抽樣應當購買樣品,所需費用按照國務院規定列支。
藥品監督管理部門對有證據證明可能危害人體健康的藥品及其有關材料,藥品監督管理部門可以採取查封、扣押的行政強制措施,並在七日內作出行政處理決定;藥品需要檢驗的,必須自檢驗報告書發出之日起十五日內作出行政處理決定。
第九十七條 國務院和省、自治區、直轄市人民政府的藥品監督管理部門應當定期公告藥品品質抽查檢驗的結果;公告不當的,必須在原公告範圍內予以更正。
第九十八條 當事人對藥品檢驗機構的檢驗結果有異議的,可以自收到藥品檢驗結果之日起七日內向原藥品檢驗機構或者上一級藥品監督管理部門設置或者確定的藥品檢驗機構申請複驗,也可以直接向國務院藥品監督管理部門設置或者確定的藥品檢驗機構申請複驗。受理複驗的藥品檢驗機構必須在國務院藥品監督管理部門規定的時間內作出複驗結論。
第九十九條 藥品監督管理部門應當按照規定,依據《藥品生產品質管制規範》、《藥品經營品質管制規範》,對經其認證合格的藥品生產企業、藥品經營企業進行認證後的跟蹤檢查。
藥品監督管理部門應當對藥品上市許可持有人、藥品生產企業、藥品經營企業和藥物非臨床安全性評價研究機構、藥物臨床試驗機構實施藥品生產品質管制規範、藥品經營品質管制規範、藥物非臨床研究品質管制規範、藥物臨床試驗品質管制規範等情況進行檢查,監督其持續符合要求。
第一百條 國家建立藥品職業化、專業化檢查員隊伍。檢查員應當具備藥品法律法規和藥品專業知識。
第一百零一條 藥品監督管理部門建立藥品上市許可持有人、藥品生產企業、藥品經營企業、藥物非臨床安全性評價研究機構、藥物臨床試驗機構和醫療機構藥品安全信用檔案,記錄許可頒發、日常監督檢查結果、違法行為查處等情況,依法向社會公佈並即時更新;對有不良信用記錄的,增加監督檢查頻次,並可以按照國家規定實施聯合懲戒。
第一百零二條 藥品監督管理部門應當公佈本部門的電子郵寄地址、電話,接受諮詢、投訴、舉報,並依法及時答覆、核實、處理。對查證屬實的舉報,按照有關規定給予舉報人獎勵。藥品監督管理部門應當對舉報人的資訊予以保密,保護舉報人的合法權益。舉報人舉報所在單位的,該單位不得以解除、變更勞動合同或者其他方式對舉報人進行打擊報復。
第一百零三條 國家實行藥品安全信息統一公佈制度。國家藥品安全總體情況、藥品安全風險警示資訊、重大藥品安全事故及其調查處理資訊和國務院確定需要統一公佈的其他資訊由國務院藥品監督管理部門統一公佈。藥品安全風險警示資訊和重大藥品安全事故及其調查處理資訊的影響限於特定區域的,也可以由有關省、自治區、直轄市人民政府藥品監督管理部門公佈。未經授權不得發佈上述資訊。
公佈藥品安全資訊,應當做到及時、準確、全面,並進行必要的說明,避免誤導。
任何單位和個人不得編造、散佈虛假藥品安全資訊。
第一百零四條 藥品監督管理部門未及時發現藥品安全系統性風險,未及時消除監督管理區域內藥品安全隱患的,本級人民政府或者上級人民政府承擔藥品監督管理職責的部門應當對其主要負責人進行約談。
地方人民政府未履行藥品安全職責,未及時消除區域性重大藥品安全隱患的,上級人民政府或者上級人民政府承擔藥品監督管理職責的部門應當對其主要負責人進行約談。
被約談的部門、地方人民政府必須立即採取措施,對藥品監督管理工作進行整改。
約談情況和整改情況應當納入地方人民政府和有關部門藥品監督管理工作評議、考核記錄。
第一百零五條 地方人民政府和藥品監督管理部門不得以要求實施藥品檢驗、審批等手段限制或者排斥非本地區藥品上市許可持有人、藥品生產企業依照本法規定生產的藥品進入本地區。
第一百零六條 藥品監督管理部門及其設置的專業技術機構藥品核對總和確定的專業從事藥品檢驗的機構不得參與藥品生產經營活動,不得以其名義推薦或者監製、監銷藥品。
藥品監督管理部門及其設置或指定的藥品檢驗機構和確定的專業從事藥品檢驗的專業技術機構的工作人員不得參與藥品生產經營活動。
第一百零七條 藥品上市許可持有人、藥品生產企業、藥品經營企業和醫療機構的藥品檢驗機構或者人員,應當接受當地藥品監督管理部門設置的藥品檢驗機構的業務指導。
第一百零八條 國家國務院對麻醉藥品、精神藥品、醫療用毒性藥品、放射性藥品,實行特殊管理。管理辦法由國務院制定和其他特殊管理規定的,依照其規定。
第十一章 法律責任
第一百零九條 未取得《藥品生產許可證》、《藥品經營許可證》或者《醫療機構製劑許可證》生產藥品、經營藥品的,責令關閉,依法予以取締,沒收違法生產、銷售的藥品和違法所得,並處違法生產、銷售的藥品(包括已售出的和未售出的藥品,下同)貨值金額二倍以上五倍以下十倍以上三十倍以下的罰款;貨值金額不足十萬元的,並處一百萬元以上三百萬元以下的罰款,構成犯罪的,依法追究刑事責任。
第一百一十條 生產、銷售假藥的,沒收違法生產、銷售的藥品和違法所得,責令停產停業整頓,吊銷藥品批准證明文件,依法追究刑事責任;依法不認為是犯罪的,並處違法生產、銷售藥品貨值金額二倍以上五倍以下十五倍以上三十倍以下的罰款;貨值金額不足十萬元的,並處一百五十萬元以上三百萬元以下的罰款,有藥品批准證明檔的予以撤銷,並責令停產、停業整頓;情節嚴重的,吊銷《藥品生產許可證》、《藥品經營許可證》或者《醫療機構製劑許可證》;構成犯罪的,依法追究刑事責任。
第一百一十一條 生產、銷售劣藥的,沒收違法生產、銷售的藥品和違法所得,並處違法生產、銷售藥品貨值金額一倍以上三倍以下十倍以上二十倍以下的罰款;貨值金額不足十萬元的,並處一百萬元以上二百萬元以下的罰款,情節嚴重的,責令停產、停業整頓或者撤銷藥品批准證明檔、吊銷《藥品生產許可證》、《藥品經營許可證》或者《醫療機構製劑許可證》;構成犯罪的,依法追究刑事責任。
第一百一十二條 從事生產、銷售假藥及生產、銷售劣藥情節嚴重的企業或者其他單位,法定代表人、主要負責人、其直接負責的主管人員和其他直接責任人員,沒收違法行為發生期間其從單位所獲收入,並處所獲收入百分之三十以上一倍以下的罰款,十年內不得從事終身不得從事藥品生產、經營活動;構成犯罪的,依法追究刑事責任。依法不認為是犯罪,或者不構成犯罪的,可以由公安機關並處五日以上十五日以下的拘留。
對生產者專門用於生產假藥、劣藥的原輔材料、包裝材料、生產設備予以沒收。
第一百一十三條 知道或者應當知道屬於假劣藥品而為其提供運輸、保管、倉儲等便利條件的,沒收全部運輸、保管、倉儲的收入,並處違法收入一倍以上五倍以下百分之五十以上三倍以下的罰款;違法收入不足十萬元的,並處十萬元以上五十萬元以下的罰款;情節嚴重的,並處違法收入五倍以上十五倍以下的罰款;構成犯罪的,依法追究刑事責任。
第一百一十四條 對假藥、劣藥的處罰決定,除本法第九十三條第三款第一項、第二項、第五項、第六項和第九十四條第三款規定外,必須載明藥品檢驗機構的品質檢驗結果。但是,本法第四十八條第三款第(一)、(二)、(五)、(六)項和第四十九條第三款規定的情形除外。
第一百一十五條 藥品上市許可持有人、藥品的生產企業、經營企業、藥物非臨床安全性評價研究機構、藥物臨床試驗機構未按照規定實施《藥品生產品質管制規範》、《藥品經營品質管制規範》、藥物非臨床研究品質管制規範、藥物臨床試驗品質管制規範的,給予警告,責令限期改正,處二萬元以上二十萬元以下的罰款;逾期不改正的,處二十萬元以上二百萬元以下的罰款責令停產、停業整頓,並處五千元以上二萬元以下的罰款;情節嚴重的,責令停產停業整頓直至吊銷藥品批准證明檔、《藥品生產許可證》、《藥品經營許可證》和藥物臨床試驗機構的資格。藥物非臨床安全性評價研究機構、藥物臨床試驗機構等五年內不得開展藥物非臨床安全性評價研究、藥物臨床試驗,對單位的法定代表人、主要負責人、直接負責的主管人員和其他責任人員,沒收違法行為發生期間其從單位所獲收入,並處所獲收入百分之十以上百分之五十以下的罰款,禁止其十年直至終身從事藥品生產、經營活動;構成犯罪的,依法追究刑事責任。
第一百一十六條 藥品上市許可持有人、藥品的生產企業、經營企業或者醫療機構違反本法第五十二條的規定,從無《藥品生產許可證》、《藥品經營許可證》的企業購進藥品的,責令改正,沒收違法購進的藥品和違法所得,並處違法購進藥品貨值金額二倍以上五倍以下二倍以上十倍以下的罰款;貨值金額不足五萬元的,並處十萬元以上五十萬元以下的罰款;有違法所得的,沒收違法所得;情節嚴重的,並處貨值金額十倍以上三十倍以下的罰款,吊銷藥品批准證明檔、《藥品生產許可證》、《藥品經營許可證》或者醫療機構執業許可證書。
第一百一十七條 藥品上市許可持有人違反本法規定,未制定藥品上市後風險管理計畫或者未提交年度報告的,責令限期改正,給予警告;逾期不改正的,處十萬元以上二十萬元以下的罰款。
第一百一十八條 藥品上市許可持有人未按照規定開展藥品不良反應監測或者報告不良反應的,責令限期改正,給予警告;逾期不改正的,責令停產停業整頓,並處五十萬元以上二百萬元以下的罰款;情節嚴重的,吊銷藥品批准證明文件。
藥品生產企業、藥品經營企業未按照規定報告藥品不良反應的,責令限期改正,給予警告;逾期不改正的,責令停產停業整頓,並處二十萬元以上二百萬元以下的罰款。
醫療機構未按照規定報告藥品不良反應的,責令限期改正,給予警告;逾期不改正的,處二十萬元以上一百萬元以下的罰款。
第一百一十九條 藥品上市許可持有人在省、自治區、直轄市人民政府藥品監督管理部門責令其召回後,拒不召回的,處應召回藥品貨值金額五倍以上十倍以下的罰款;貨值金額不足十萬元的,處五十萬元以上一百萬元以下的罰款;情節嚴重的,吊銷藥品批准證明檔、藥品生產許可證、藥品經營許可證。藥品生產企業、藥品經營企業、醫療機構拒不配合召回的,處十萬元以上五十萬元以下的罰款。
第一百二十條 藥品上市許可持有人、藥品生產企業、藥品經營企業或者醫療機構聘用人員違反本法規定的,責令解聘,處五萬元以上二十萬元以下的罰款。
第一百二十一條 藥品上市許可持有人為境外企業的,其在中國境內設立的代表機構或者指定的企業法人未依照本法規定履行相關義務的,責令改正,處十萬元以上二十萬元以下的罰款;拒不改正的,責令暫停相關藥品銷售,並處二十萬元以上五十萬元以下的罰款;情節嚴重的,禁止該企業法人五年內從事藥品生產、經營活動。
第一百二十二條 藥品網路銷售協力廠商平臺提供者違反本法規定,未履行資質審查、報告、停止提供網路銷售平臺服務等義務的,責令改正,沒收違法所得,並處二十萬元以上一百萬元以下的罰款;情節嚴重的,責令停業整頓,並處一百萬元以上五百萬元以下的罰款。
第一百二十三條 進口已獲得藥品進口註冊證書的藥品,未按照本法規定向允許藥品進口的口岸所在地承擔藥品監督管理職責部門登記備案的,給予警告,責令限期改正;逾期不改正的,撤吊銷進口藥品註冊證書。
第一百二十四條 偽造、變造、買賣、出租、出借許可證或者藥品批准證明文件的,沒收違法所得,並處違法所得一倍以上三五倍以下的罰款;沒有違法所得的或者違法所得不足十萬元的,處二萬元以上十萬元以下十萬元以上五十萬元以下的罰款;情節嚴重的,處違法所得五倍以上十五倍以下的罰款,沒有違法所得或者違法所得不足十萬元的,處五十萬元以上一百五十萬元以下的罰款,並吊銷賣方、出租方、出借方的《藥品生產許可證》、《藥品經營許可證》、《醫療機構製劑許可證》或者撤銷藥品批准證明檔;構成犯罪的,依法追究刑事責任。
第一百二十五條 違反本法規定,提供虛假的證明、檔資料、樣品或者採取其他欺騙手段取得《藥品生產許可證》、《藥品經營許可證》、《醫療機構製劑許可證》或者藥品批准證明檔的,吊銷《藥品生產許可證》、《藥品經營許可證》、《醫療機構製劑許可證》或者撤銷藥品批准證明檔,五十年內不受理其申請,並處五十萬元以上五百萬元以下一萬元以上三萬元以下的罰款。
第一百二十六條 醫療機構違反本法規定,將其配製的製劑在市場銷售的,責令改正,沒收違法銷售的製劑,並處違法銷售製劑貨值金額一倍以上三五倍以下的罰款;貨值金額不足十萬元的,並處十萬元以上五十萬元以下的罰款;情節嚴重的,並處貨值金額五倍以上十五倍以下的罰款。有違法所得的,沒收違法所得。
第一百二十七條 藥品經營企業違反本法第五十四條、第五十五條規定的,責令改正,給予警告;情節嚴重的,吊銷《藥品經營許可證》。
第一百二十八條 藥品標識不符合本法第五十四四十七條規定的,除依法應當按照假藥、劣藥論處的外,責令改正,給予警告;情節嚴重的,吊銷撤銷該藥品的註冊證書批准證明檔。
第一百二十九條 有下列行為之一的,在本法規定的處罰幅度內從重處罰:
(一)以麻醉藥品、精神藥品、醫療用毒性藥品、放射性藥品冒充其他藥品,或者以其他藥品冒充上述藥品的;
(二)生產、銷售以孕產婦、嬰幼兒及兒童為主要使用對象的假藥、劣藥的;
(三)生產、銷售的生物製品屬於假藥、劣藥的;
(四)生產、銷售假藥、劣藥,造成人員傷害後果的;
(五)生產、銷售假藥、劣藥,經處理後重犯的;
(六)拒絕、逃避監督檢查,或者偽造、銷毀、隱匿有關證據材料的,或者擅自動用查封、扣押物品的。
第一百三十條 藥品檢驗機構出具虛假檢驗報告的,構成犯罪的,依法追究刑事責任;不構成犯罪的,責令改正,給予警告,對單位並處十萬元以上一百萬元以下三萬元以上五萬元以下的罰款;對直接負責的主管人員和其他直接責任人員依法給予降級、撤職、開除的處分,並處三萬元以下的罰款;有違法所得的,沒收違法所得;情節嚴重的,撤銷其檢驗資格。藥品檢驗機構出具的檢驗結果不實,造成損失的,應當承擔相應的賠償責任,構成犯罪的,依法追究刑事責任。
第一百三十一條 本法第一百零九條至第一百三十條規定的行政處罰,由縣級以上藥品監督管理部門按照國務院藥品監督管理部門規定的職責分工決定;吊銷《藥品生產許可證》、《藥品經營許可證》、《醫療機構製劑許可證》、醫療機構執業許可證書或者撤銷藥品批准證明檔的,由原發證、批准的部門決定。
第一百三十二條 違反關於有關藥品價格管理的規定的,依照《中華人民共和國價格法》的規定處罰。
第一百三十三條 藥品上市許可持有人、藥品的生產企業、經營企業、醫療機構在藥品購銷中暗中給予、收受回扣或者其他利益的,藥品上市許可持有人藥品的生產企業、經營企業或者其代理人給予使用其藥品的醫療機構的負責人、藥品採購人員、醫師等有關人員以財物或者其他利益的,由市場監督管理部門工商行政管理部門處三十萬元以上三百萬元以下一萬元以上二十萬元以下的罰款,有違法所得的,予以沒收沒收違法所得;情節嚴重的,由市場監督管理部門吊銷藥品上市許可持有人、藥品生產企業、藥品經營企業的營業執照,並通知藥品監督管理部門,由藥品監督管理部門吊銷其藥品批准證明檔、《藥品生產許可證》、《藥品經營許可證》;構成犯罪的,依法追究刑事責任。
藥品上市許可持有人、藥品生產企業、藥品經營企業在藥品研製、生產、經營中向國家工作人員行賄的,其法定代表人、主要負責人、直接負責的主管人員和其他責任人員終身不得從事藥品生產、經營活動;構成犯罪的,依法追究刑事責任。
第一百三十四條 藥品上市許可持有人、藥品的生產企業、經營企業的負責人、採購人員等有關人員在藥品購銷中收受其他藥品上市許可持有人、藥品生產企業、藥品經營企業或者其代理人給予的財物或者其他利益的,依法給予處分,沒收違法所得;構成犯罪的,依法追究刑事責任。
醫療機構的負責人、藥品採購人員、醫師等有關人員收受藥品上市許可持有人、藥品生產企業、藥品經營企業或者其代理人給予的財物或者其他利益的,由衛生健康主管部門或者本單位給予處分,沒收違法所得;對違法行為情節嚴重的執業醫師,由衛生健康主管部門吊銷其執業證書;構成犯罪的,依法追究刑事責任。
第一百三十五條 違反本法有關藥品廣告的管理規定的,依照《中華人民共和國廣告法》的規定處罰,並由發給廣告批准文號的藥品監督管理部門撤銷廣告批准文號,一年內不受理該品種的廣告審批申請;構成犯罪的,依法追究刑事責任。
藥品監督管理部門對藥品廣告不依法履行審查職責,批准發佈的廣告有虛假或者其他違反法律、行政法規的內容的,對直接負責的主管人員和其他直接責任人員依法給予行政處分;構成犯罪的,依法追究刑事責任。
第一百三十六條 藥品上市許可持有人、藥品的生產企業、經營企業、醫療機構違反本法規定,給藥品使用者造成損害的,依法承擔賠償責任。
生產假藥、劣藥或者明知是假藥、劣藥仍然銷售,造成死亡或者健康嚴重損害的,受害者或者其近親屬除要求賠償損失外,還可以要求相應的懲罰性賠償。
第一百三十七條 藥品監督管理部門違反本法規定,有下列行為之一的,由其上級主管機關或者監察機關責令收回違法發給的證書、撤銷藥品批准證明文件,對直接負責的主管人員和其他直接責任人員依法給予行政處分;構成犯罪的,依法追究刑事責任:
(一)對不符合《藥品生產品質管制規範》、《藥品經營品質管制規範》的企業發給符合有關規範的認證證書的,或者對取得認證證書的企業未按照規定履行跟蹤檢查的職責,對不符合認證條件的企業未依法責令其改正或者撤銷其認證證書的;
(一)對不符合法定條件的單位發給《藥品生產許可證》、《藥品經營許可證》或者《醫療機構製劑許可證》的;
(二)對不符合進口條件的藥品發給進口藥品註冊證書的;
(三)對不具備臨床試驗條件或者生產條件而批准進行臨床試驗、發給藥品註冊證書的。新藥證書、發給藥品批准文號的。
第一百三十八條 違反本法規定,編造、散佈虛假藥品安全資訊,構成違反治安管理行為的,由公安機關依法給予治安管理處罰;構成犯罪的,依法追究刑事責任。
第一百三十九條 藥品監督管理部門或者其設置、指定的的藥品檢驗機構或者其確定的專業從事藥品檢驗的專業技術機構參與藥品生產經營活動的,由其上級主管機關或者監察機關責令改正,有違法收入的予以沒收沒收違法所得;情節嚴重的,對直接負責的主管人員和其他直接責任人員依法給予行政處分。
藥品監督管理部門或者其設置、指定的的藥品檢驗機構或者其確定的專業從事藥品檢驗的專業技術機構的工作人員參與藥品生產經營活動的,依法給予行政處分。
第一百四十條 藥品監督管理部門或者其設置、確指定的藥品檢驗機構在藥品監督檢驗中違法收取檢驗費用的,由政府有關部門責令退還,對直接負責的主管人員和其他直接責任人員依法給予行政處分。對違法收取檢驗費用情節嚴重的藥品檢驗機構,撤銷其檢驗資格。
第一百四十一條 藥品監督管理部門應當依法履行監督檢查職責,監督已取得《藥品生產許可證》、《藥品經營許可證》的藥品生產企業,藥品經營企業依照本法規定從事藥品生產、經營活動。
已取得《藥品生產許可證》、《藥品經營許可證》的企業生產、銷售假藥、劣藥的,除依法追究該企業的法律責任外,對有失職、瀆職行為的藥品監督管理部門直接負責的主管人員和其他直接責任人員依法給予行政處分;構成犯罪的,依法追究刑事責任。
第一百四十二條 上級藥品監督管理部門對下級藥品監督管理部門違反本法的行政行為,責令限期改正;逾期不改正的,有權予以改變或者撤銷。
第一百四十三條 違反本法規定,縣級以上地方人民政府有下列行為之一的,對直接負責的主管人員和其他直接責任人員給予記過或者記大過處分;情節嚴重的,給予降級、撤職或者開除處分:
(一)履行職責不力,造成嚴重不良影響或者重大損失的;
(二)隱瞞、謊報、緩報藥品安全事故的;
(三)本行政區域內發生特別重大藥品安全事故,或者連續發生重大藥品安全事故的。
第一百四十四條 違反本法規定,藥品監督管理部門有下列行為之一的,對直接負責的主管人員和其他直接責任人員給予記過或者記大過處分;情節較重的,給予降級或者撤職處分;情節嚴重的,給予開除處分:
(一)隱瞞、謊報、緩報藥品安全事故的;
(二)對發現的藥品安全違法行為未及時查處的;
(三)未及時發現藥品安全系統性風險,或者未及時消除監督管理區域內藥品安全隱患,造成嚴重影響的;
(四)其他不履行藥品監督管理職責,造成嚴重不良影響或者重大損失的。
第一百四十五條 藥品監督管理人員濫用職權、徇私舞弊、怠忽職守,構成犯罪的,依法追究刑事責任;尚不構成犯罪的,依法給予行政處分,構成犯罪的,依法追究刑事責任。
第一百四十六條 本章規定的貨值金額以違法生產、銷售藥品的標價計算;沒有標價的,按照同類藥品的市場價格計算。
第十二章 附則
第一百四十七條 本法下列用語的含義是:
藥品,是指用於預防、治療、診斷人的疾病,有目的地調節人的生理機能並規定有適應症或者功能主治、用法和用量的物質,包括中藥材、中藥飲片、中成藥、化學原料藥及其製劑、抗生素、生化藥品、放射性藥品、血清、疫苗、血液製品和診斷藥品等。
輔料,是指生產藥品和調配處方時所用的賦形劑和附加劑。
藥品生產企業,是指生產藥品的專營企業或者兼營企業。
藥品經營企業,是指經營藥品的專營企業或者兼營企業。
第一百四十八條 中藥材的種植、採集和飼養的管理辦法,依照有關法律、行政法規的規定執行。由國務院另行制定。
第一百四十九條 地區性民間慣用藥材的管理辦法,由國務院藥品監督管理部門會同國務院中醫藥管理部門制定。
第一百零二條 國家對預防性生物製品的流通實行特殊管理。具體辦法由國務院制定。
第一百五十條 中國人民解放軍執行本法的具體辦法,由國務院、中央軍事委員會依據本法制定。