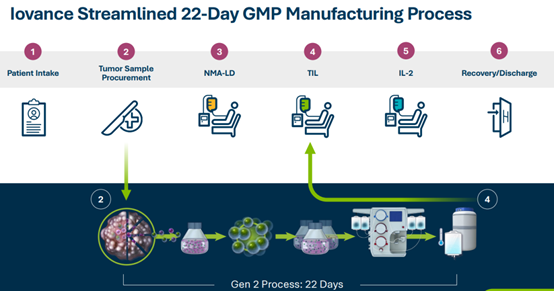
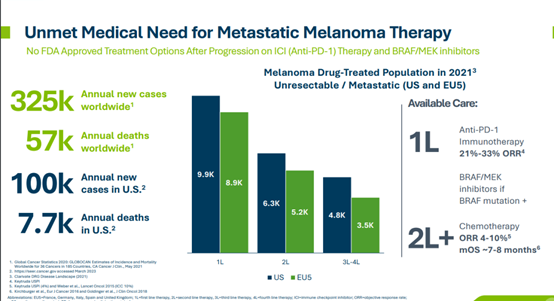
Beijing Da Xue Xue Bao Yi Xue Ban. 2019 Jun 18; 51(3): 591–595.
Chinese. doi: 10.19723/j.issn.1671-167X.2019.03.032
Abstract
目的
評估同種異體自然殺傷(natural killer, NK)細胞治療原發性肝癌的安全性和有效性,並探討其抗腫瘤機制。
方法
對21例經同種異體NK細胞治療的原發性肝細胞癌患者進行1年隨訪,通過對其生存期、影像學指標、血液學指標、生物化學指標及免疫學指標分析,評價該治療的安全性和有效性,分析患者經過治療後外周血淋巴細胞亞群的變化。
結果
(1)21例原發性肝癌患者中,11例患者治療1次,5例患者治療2次,5例患者治療3次,患者治療後未見嚴重不良反應,10例患者有一過性發熱,1例患者出現肝區疼痛,1例患者出現頭痛,未經治療均於8 h內自行緩解;(2)在一年隨訪中,總疾病控制率為76.2%,其中Barcelona分期(Barcelona clinic liver cancer, BCLC)A期患者中疾病控制率為100%, 病情穩定(stable disease, SD)10例;BCLC B期患者中疾病控制率為60%,部分緩解(partial response, PR)1例,SD 2例;BCLC C期患者中疾病控制率為50%,完全緩解(complete response, CR)1例,PR 2例;(3)患者治療後24 h外周血NK細胞和CD8+T細胞頻率較治療前顯著降低,CD4+T細胞頻率和CD4/CD8較治療前顯著上升。
結論:同種異體NK細胞治療原發性肝細胞癌有很好的安全性和有效性。
Keywords: NK細胞, 肝細胞癌, 同種異體, 外周免疫
肝細胞癌(hepatocellular carcinoma, HCC)目前是全球惡性腫瘤相關死亡的第三大原因,NK細胞是天然免疫的重要組成部分,在清除病毒感染的細胞和腫瘤細胞中起關鍵作用。在慢性肝炎發展為肝癌的過程中,NK細胞功能缺陷與疾病進展密切相關,同時也是造成腫瘤細胞免疫逃逸的重要原因[1]。與正常肝組織相比,肝細胞癌患者瘤內NK細胞數量降低、細胞亞群分佈改變,識別和殺傷肝癌細胞的功能降低[2,3]。近期研究表明,自體NK細胞治療在多種實體瘤的治療中可以提高外周迴圈中NK細胞的活性和數量,但由於很難遷移到腫瘤部位發揮功能,臨床療效有限[4,5]。同種異體NK細胞治療近年來被廣泛應用於各種臨床試驗。殺傷細胞免疫球蛋白樣受體(killer cell immunoglobulin-like receptor, KIR)不匹配可以抑制自體組織相容性複合體(major histocompatibility conplex, MHC)分子的負向調控信號,保證足夠的NK細胞活化。在急性髓系白血病(acute myelocytic leukemia, AML)患者中,來自KIR不匹配供體的NK細胞過繼回輸可顯著降低造血幹細胞移植後的復發率[6]。本研究以患者的健康直系血親為供者,分離外周血單個核細胞並進行NK細胞的體外培養,在培養後的第14、15天,分2次回輸給患者,通過對患者進行隨訪,同時評估同種異體NK細胞治療的安全性和有效性。
Go to:
1. 資料與方法
1.1. 研究物件
選擇2016年4月至2017年10月在解放軍總醫院第五醫學中心收治的HCC患者。
患者納入標準:(1)年齡16~65歲的男性或女性患者;(2)按照《原發性肝癌診療標準(2015年版)》, 患者經病理學和影像學確診為原發性肝細胞癌;肝功能Child-Pugh A/B級 (5~9分),美國東部腫瘤協作組評分標準(eastern cooperative oncology group score standard, ECOG)評分≤ 2分;(3)血小板計數>60×109 /L;血紅蛋白>80 g/L;凝血:國際標準化比率(international normalized ratio, INR)<2.3,或者凝血時間延長<6 s;血清白蛋白>28 g/L,總膽紅素<51 mmol/L,穀丙/穀草轉氨酶<5倍正常值上限;(4)合併乙肝患者進行抗病毒治療,合併丙肝患者服用直接抗病毒(direct-acting antiviral agents, DAA)藥物治療。供者入組標準:(1)年齡18~40 歲的男性或女性且為患者直系血親;(2)理解並簽署知情同意書,且遵循自願、無償的原則;(3)排除糖尿病、高血壓、心臟病等慢性疾病,全身無其他重大器質性疾病和傳染性疾病;(4)沒有精神障礙,具有完全的行為能力。
患者排除標準:(1)妊娠或哺乳期婦女;(2)器官移植後患者;(3)2 周內進行過介入微創治療術或者1 個月內進行過切除手術的患者;(4)合併甲型肝炎、戊型肝炎、愛滋病等感染者,或有其他傳染性疾病;(5)合併其他嚴重的全身性疾病和精神病患者;(6)篩選前30 d內發生過急性感染、消化道出血等嚴重併發症;(7)半年內進行過其他生物治療,包括細胞因數誘導的殺傷細胞(cytokine-induced killer cells, CIK)、樹突狀細胞(dendritic cells,DCs)、嵌合抗原受體T細胞(chimeric antigen receptor T-cells, CAR-T)、程式性死亡受體1(programmed cell death protein 1, PD-1)和其他免疫治療的患者。
共入組HCC患者21例,其中男性18例,女性3例,基線資料見表1。本項臨床研究通過中國人民解放軍第三零二醫院醫學倫理委員會審查批准,所有入組患者和供者均理解並簽署知情同意書。
1
患者的人口學和基線特徵
Demographic and baseline characteristics of the patients
| Variable |
Data |
| ECOG, eastern cooperative oncology group score standard; BCLC, Barcelona clinic liver cancer. |
| Age/years |
56.1±7.6 |
| Gender, n(%) |
|
| Male |
18 (86) |
| Female |
3 (14) |
| Cause ofdisease, n(%) |
|
| Alcoholic liver disease |
1 (5) |
| Hepatitis B only |
16 (76) |
| Other |
4 (19) |
| ECOG performancestatus, n(%) |
|
| 0 |
8 (38) |
| 1 |
11 (52) |
| 2 |
2 (10) |
| BCLC stage, n(%) |
|
| A |
10 (48) |
| B |
5 (24) |
| C |
6 (28) |
| Child-Pugh class, n(%) |
|
| A |
17(81) |
| B |
4(19) |
| Biochemical analysis |
|
| albumin/(g/L) |
|
| Median |
40.6 |
| Range |
27.0-46.0 |
| Totalbilirubin/(μmol/L) |
|
| Median |
14.3 |
| Range |
8.9-63.6 |
| Alpha-fetoprotein/(μg/L) |
|
| Median |
20.6 |
| Range |
2.2-1210.0 |
Open in a separate window
1.2. 細胞製備及質控
包被:取NK細胞啟動劑2 mL至175 cm2培養瓶中,加入20 mL生理鹽水充分混勻並置於4 ℃冰箱過夜。
外周血單核細胞(peripheral blood mononuclear cell, PBMC)分離:採集供者外周血50~80 mL,通過Ficoll-Hypaque密度梯度離心,800 ×g,25 min;收集上層血漿並於56 ℃滅活30 min;收集單核細胞層細胞,加入生理鹽水重懸,300 ×g,10 min洗滌2次。
細胞培養:用10 mL生理鹽水沖洗包被的培養瓶,將PBMC重懸於NK細胞活化培養基中,使其密度為1×106/mL,分別按照終濃度為50 μg/L、1 000 IU/mL和2.5%分別加入重組人IL-15、重組人IL-2和滅活血漿,混勻後接種于包被培養瓶中;置於37 ℃,5% CO2飽和濕度培養箱中培養72 h;觀察細胞生長狀況並加入擴增培養基,調節細胞密度至5×105~8×105/mL,按照初始培養濃度加入細胞因數和滅活血漿,每2~3天傳代1次。
細胞收穫:培養14 d和15 d後,用生理鹽水重量細胞300 ×g,8 min洗滌細胞2次,用含1%(體積分數)注射用人白蛋白的生理鹽水懸浮細胞,經70 μm細胞篩過濾後轉移至輸液袋。
細胞質控:分別于培養第0、7、14天取細胞培養懸液進行品質檢測,質檢內容包括微生物學安全性(細菌、真菌、支原體、內毒素檢測)和生物學活性(細胞活率、NK細胞純度、NK細胞分泌細胞因數水準、NK細胞殺傷功能檢測)。
1.3. 隨訪檢查
首次NK細胞治療開始後4周、8周、12周、24周、36周、48周定期隨訪。隨訪觀察指標包括安全性指標(發熱及其他不適、血常規、肝腎功能、心電圖)和有效性指標(臨床症狀及體征、腫瘤標誌物水準、生物化學指標、影像學指標、免疫學指標及生活品質評價)。
1.4. 統計學分析
採用SPSS 19.0統計軟體,統計結果用 x±s表示。採用配對t檢驗比較NK細胞治療前後臨床及實驗室檢查結果,P<0.05認為差異有統計學意義。
Go to:
2. 結果
2.1. 同種異體NK細胞治療安全性評價
21例患者中,10例患者治療1療程,5例患者治療2療程,5例患者治療3療程。所有患者未見噁心、嘔吐、感染、過敏、昏迷、急性和慢性移植物抗宿主反應(graft-versus-host disease, GVHD)。10例患者在細胞輸注後24 h內出現短暫發熱反應,其中9例患者體溫為37.3~38.5 ℃,1例患者體溫為38.5~39.5 ℃。1例患者接受NK細胞治療12 h後出現輕微肝痛,1例患者出現輕微頭痛。以上所有患者的症狀均在8 h內自然緩解,無需治療。結果表明,該劑量的NK細胞治療不超過患者的耐受限度。
在1年的隨訪中,同種異體NK細胞治療後3個月內患者淋巴細胞數量逐漸減少,但差異無統計學意義。治療3個月後淋巴細胞計數恢復至治療前水準,6個月後淋巴細胞計數高於基線,然後緩慢恢復到原水準。中性粒細胞和血小板水準無明顯變化。治療後患者谷丙轉氨酶(alanine aminotransferase, ALT)、穀草轉氨酶(aspartate aminotransferase, AST)、總膽紅素(total bilirubin, TBil)、白蛋白(albumin, ALB)均在正常範圍內波動,與基線比較差異無統計學意義,甲胎蛋白(alpha fetoprotein, AFP)水準較NK細胞治療前顯著降低。
2.2. 同種異體NK細胞治療療效評價
按照實體瘤療效評價(response evaluation criteria in solid tumors, RECIST)1.1標準[7], 21例同種異體NK細胞治療的HCC患者1年隨訪中,1例(4%)完全緩解,3例(12%)部分緩解,12例(52%)病情穩定。所有患者的總疾病控制率為76.2%(表2),其中BCLC(Barcelona clinic liver cancer) A期患者中疾病控制率為100%, SD 10例;BCLC B期患者中疾病控制率為60%,部分緩解(partial response, PR) 1例,SD 2例;BCLC C期患者中疾病控制率為50%,完全緩解(complete response, CR) 1例,PR 2例。截至2019年5月,接受同種異體NK細胞治療的21例患者中有5例死亡。死亡患者中BCLC C期患者3例,存活時間分別為3個月、4個月和4個月;BCLC B期患者2例,存活時間分別為4個月後、10個月。
2
NK細胞治療療效評價
Summary of efficacy measures
| BCLC staging |
Total |
Complete response (CR) |
Partialresponse (PR) |
Stable disease (SD) |
Disease-control rate/% |
| A |
10 |
0 |
0 |
10 (100%) |
100 |
| B |
5 |
0 |
1 (20%) |
2 (40%) |
60 |
| C |
6 |
1 (17%) |
2 (33%) |
0 |
50 |
Open in a separate window
2.3. 同種異體NK細胞治療後外周免疫變化
同種異體NK細胞過繼回輸後24 h,患者CD4+ T細胞的頻率和CD4/CD8比值較基線顯著升高(圖1),而NK細胞和CD8+ T細胞的頻率較基線顯著下降,B細胞頻率較治療前差異無統計學意義。考慮到所培養的NK細胞和患者PBMC存在互相殺傷的可能,分別以患者PBMC和供者培養後的NK細胞為靶細胞進行單向混合淋巴細胞培養,發現無論是否加入IL-2,供者培養後的NK細胞對患者PBMC均無殺傷作用,但具有正常殺傷腫瘤細胞系的能力。

1
NK細胞治療24 h後患者外周血淋巴細胞亞群變化
Changes in the proportion of lymphocyte subsets 24 h after treatment
*P<0.05, ☆P<0.001.
Go to:
3. 討論
早期的基礎研究顯示,在造血幹細胞移植和骨髓移植過程中CD56(bright) NK細胞的百分比與GVHD的發生密切相關,當移植物中CD56(bright) NK細胞超過3%時,GVHD發生的概率接近於零[8,9,10]。本實驗培養NK細胞的中位元頻率為80%,遠遠超過造血幹細胞移植和骨髓移植中CD56(bright) NK細胞的頻率,但在本試驗研究的1年隨訪過程中,研究沒有觀察到急性和慢性GVHD的發生,提示同種異體NK細胞在原發肝癌的臨床應用中有很好的安全性。本研究結果顯示,疾病控制率與同種異體NK細胞治療的療程有關,治療的療程數越多,疾病控制率越高,提示異體NK細胞在患者體內存在半衰期,多次治療可能會提高治療療效,但由於本臨床試驗樣本量較小,難以控制和調整混雜因素,這一結果還需要通過大樣本臨床試驗進一步驗證。
本研究檢測了同種異體NK細胞過繼輸注後HCC患者外周血淋巴亞群的變化,發現雖然短期內輸入了了大量的外源性NK細胞,但患者外周血中NK細胞的數量和頻率仍然低於治療前水準。同種異體NK細胞輸注後患者外周血CD8 T細胞和NK細胞數量在24 h內降至最低,B細胞在48 h內降至最低,1周後逐漸恢復至正常水準,這一結果與Qin等[11]的報導相反。本研究將培養的NK細胞與未處理的HCC患者PBMC體外共培養24 h,未觀察到培養的NK細胞對患者PBMC的殺傷作用,也未觀察到患者PBMC對培養NK細胞的殺傷作用,這一結果可能與Miller等[12]報導的單倍體NK細胞過繼回輸後異體NK細胞在患者體內嵌合現象有關。本研究推測,大劑量同種異體CD56(bright) NK細胞過繼輸注後,可能通過分泌細胞因數啟動患者的自然免疫和特異性免疫,誘導患者特異性CD8+T細胞和NK細胞向腫瘤部位遷移,改變腫瘤局部微環境並殺傷腫瘤細胞。
本研究6例晚期肝癌患者1例治療後完全緩解,回顧分析發現該患者在接收同種異體NK細胞治療同時也接受索拉非尼治療,提示同種異體NK細胞聯合索拉非尼可能會延長患者的生存時間。索拉非尼是晚期HCC的靶向治療藥物,據Llovet等[13]在N Engl J Med報導,索拉非尼可使晚期HCC患者的中位生存期延長近3個月,但在299例單用索拉非尼治療的患者中,沒有一例患者達到CR。回顧2012—2018年在解放軍總醫院第五醫學中心感染性疾病診療與研究中心接受索拉非尼治療的患者,也沒有發現CR病例。此外,索拉非尼的副作用和耐藥性仍然存在,這極大地限制了索拉非尼的臨床應用。既往研究表明[14,15],索拉非尼可觸發腫瘤相關巨噬細胞(tumor-associated macrophage, TAM)的促炎活性,繼而誘導抗腫瘤NK細胞反應,提示NK細胞治療聯合索拉非尼可使患者獲得更好的臨床療效。在研究3例同種異體NK細胞聯合索拉非尼患者的總生存時間分別為16個月、19個月、32個月,均存活到2019年5月,遠遠超過報導的10.3個月,提示同種異體NK細胞聯合索拉菲尼在晚期肝癌的治療中可能具有巨大的潛力。
綜上所述,同種異體NK細胞治療HCC有很好的安全性和有效性,對延長患者生存時間、提高生活品質可能具有良好的治療前景。但仍需要進一步通過大樣本、多中心、隨機對照研究評估同種異體NK細胞聯合索拉菲尼治療晚期肝癌的療效。
(本文編輯:王蕾)
Go to:
Biography

王福生,中國科學院院士,教授,主任醫師,博士生導師。國家傑出青年基金獲得者,國家自然科學基金創新研究群體牽頭人,國家感染性疾病臨床醫學研究中心牽頭人,解放軍總醫院第五醫學中心感染病診療與研究中心主任。擅長病毒性肝炎、愛滋病和疑難危重肝病的臨床診治工作,並結合臨床難題開展研究,系統地揭示了乙型肝炎臨床免疫學特徵及肝臟損傷機制,提出了優化慢性乙肝抗病毒治療與免疫應答恢復的“爬坡假說”,闡明了愛滋病免疫重建失敗的關鍵機制,開拓了疑難肝病和愛滋病細胞治療與研究的新方向。曾先後主持多項國家重大科研項目,以通信作者在N Engl J Med、Gastroenterology、Hepatology、Blood等期刊發表論文160餘篇,獲得國家科技進步獎二等獎3項、省部級獎一等獎3項。
Go to:
Funding Statement
國家自然科學基金(81721002,81571567)
Supported by the National Natural Science Foundation of China(81721002,81571567)
Go to:
References
- Boni C, Lampertico P, Talamona L, et al. Natural killer cell phenotype modulation and natural killer/T-cell interplay in nucleos(t)ide analogue-treated hepatitis e antigen-negative patients with chronic hepatitis B. Hepatology. 2015;62(6):1697–1709. [PubMed] [Google Scholar]
- Cai L, Zhang Z, Zhou L, et al. Functional impairment in circulating and intrahepatic NK cells and relative mechanism in hepatocellular carcinoma patients. Clin Immunol. 2008;129(3):428–437. [PubMed] [Google Scholar]
- Easom NJW, Stegmann KA, Swadling L, et al. IL-15 overcomes hepatocellular carcinoma-induced NK cell dysfunction. Front Immunol. 2018;9:1009. [PMC free article] [PubMed] [Google Scholar]
- Liu P, Chen L, Zhang H. Natural killer cells in liver disease and hepatocellular carcinoma and the NK cell-based immunotherapy [J/OL]. J Immunol Res, 2018, 2018: 1206737.(2018-09-04)[2019-03-01].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6142725/.
- Parkhurst MR, Riley JP, Dudley ME, et al. Adoptive transfer of autologous natural killer cells leads to high levels of circulating natural killer cells but does not mediate tumor regression. Clin Cancer Res. 2011;17(19):6287–6297. [PMC free article] [PubMed] [Google Scholar]
- Guillerey C, Huntington ND, Smyth MJ. Targeting natural killer cells in cancer immunotherapy. Nat Immunol. 2016;17(9):1025–1036. [PubMed] [Google Scholar]
- Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1) Eur J Cancer. 2009;45(2):228–247. [PubMed] [Google Scholar]
- Wong PPC, Kariminia A, Jones D, et al. Plerixafor effectively mobilizes CD56 (bright) NK cells in blood, providing an allograft predicted to protect against GVHD. Blood. 2018;131(25):2863–2866. [PubMed] [Google Scholar]
- Ullrich E, Salzmann-Manrique E, Bakhtiar S, et al. Relation between acute GVHD and NK cell subset reconstitution following allogeneic stem cell transplantation. Front Immunol. 2016;7:595. [PMC free article] [PubMed] [Google Scholar]
- Kariminia A, Ivison S, Ng B, et al. CD56 (bright) natural killer regulatory cells in filgrastim primed donor blood or marrow products regulate chronic graft-versus-host disease: the Canadian Blood and Marrow Transplant Group randomized 0601 study results. Haematologica. 2017;102(11):1936–1946. [PMC free article] [PubMed] [Google Scholar]
- Qin Z, Chen J, Zeng J, et al. Effect of NK cell immunotherapy on immune function in patients with hepatic carcinoma: a preliminary clinical study. Cancer Biol Ther. 2017;18(5):323–330. [PMC free article] [PubMed] [Google Scholar]
- Miller JS, Soignier Y, Panoskaltsis-Mortari A, et al. Successful adoptive transfer and in vivo expansion of human haploidentical NK cells in patients with cancer. Blood. 2005;105(8):3051–3057. [PubMed] [Google Scholar]
- Llovet JM, Ricci S, Mazzaferro V, et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008;359(4):378–390. [PubMed] [Google Scholar]
- Kohga K, Takehara T, Tatsumi T, et al. Sorafenib inhibits the shedding of major histocompatibility complex class Ⅰ-related chain A on hepatocellular carcinoma cells by down-regulating a disintegrin and metalloproteinase 9. Hepatology. 2010;51(4):1264–1273. [PubMed] [Google Scholar]
- Sprinzl MF, Reisinger F, Puschnik A, et al. Sorafenib perpetuates cellular anticancer effector functions by modulating the crosstalk between macrophages and natural killer cells. Hepatology. 2013;57(6):2358–2368. [PubMed] [Google Scholar]