http://caifuhao.eastmoney.com/news/20240316093632518316260
2022年2月,國家癌症中心發佈了最新一期的全國癌症統計資料,從全國682個癌症監測點中遴選487個高品質監測點,覆蓋人口達3.8億,詳盡闡述了2016年中國癌症疾病負擔情況。2022年中美兩國癌症數據:中國新發癌症人數為美國2倍,死亡人數為5倍。
中國作為全球發展中最大國家,隨著經濟飛速發展,人們不良生活習慣和環境污染等因素使得惡性腫瘤發病率與衰亡率均逐年上升,腫瘤已成為威脅國人生命健康首要要素,使得讓腫瘤干預問題面臨嚴峻考驗。
目前傳統干預腫瘤方法包括手術、放療和化療三種,但效果均不盡人意,且對人體會產生不同程度副反應。近年來,隨著生物技術的飛速發展,免疫療法可以說開創了腫瘤治療新紀元。這種“新型”抗癌方式,也讓科學家們爭相投入探索更具潛力的免疫細胞治療中,為癌症免疫治療提供更多可選擇的策略。
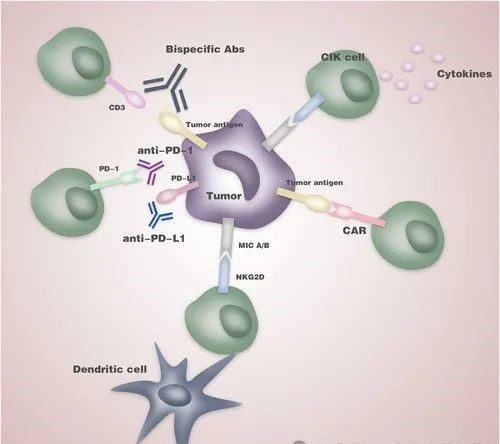
自然殺傷細胞(NK細胞)就是其中的一種。它的抗癌廣譜性受到了一眾科學家的追捧,而NK細胞也同樣不負眾望,顯示出良好的腫瘤殺傷效果,基於NK細胞的多種抗癌策略也得到了進一步開發。
近日,學者在《International Journal of Molecular Sciences》發表了綜述,進一步總結了癌症免疫治療和自然殺傷細胞(NK細胞)這一領域的發展概況,幫助人們瞭解這一種細胞在癌症治療領域的潛力與應用。
認識NK細胞
NK細胞,也稱自然殺傷細胞(Natural Killer Cell),來源於骨髓淋巴樣幹細胞,其分化、發育依賴於骨髓及胸腺微環境,主要分佈於骨髓、外周血、肝、脾、肺和淋巴結。NK細胞對幾乎所有常見的癌細胞類型都有殺傷作用,包括肺癌、乳腺癌、肝癌、淋巴癌、食道癌等;對多重耐藥腫瘤細胞同樣具有殺傷作用,被醫學界公認為抗癌衛士。在20年前治療晚期白血病患者過程中,NK細胞介導的免疫療法已成為一種安全有效的療法。隨著時間的推移、醫學研究的深入、醫療技術的發展,有關NK細胞的抗癌研究呈指數增長,成為免疫療法創新的主要領域。
NK細胞為何成為抗癌第一防線
NK細胞對癌細胞的殺傷作用具有直接、靈敏、反應速度快等特點。可非特異性直接殺傷腫瘤細胞,這種天然殺傷活性既不需要抗原參與,也不需要抗體參與,且無MHC限制。除了具有強大的殺傷功能外,還具有很強的免疫調節功能,與機體其他多種免疫細胞相互作用,調節機體的免疫狀態和免疫功能。臨床研究發現NK細胞過繼免疫治療惡性腫瘤具有良好的應用前景,對多種實體瘤和血液系統惡性腫瘤均有一定效果。NK細胞遊弋在全身血管行使免疫監視功能,能在第一時間發現並啟動免疫防禦功能,迅速殺死病變、癌變的細胞,因此被醫學界公認為抗癌第一道防線。
NK細胞的抗腫瘤效應機制
除了直接誘導細胞毒性外,NK細胞還通過產生促炎性細胞因數(包括IFN和TNF)對轉化細胞作出反應。這些多效性蛋白質除了能夠增強細胞毒性CD8+T細胞反應外,對癌細胞具有強大的抗增殖、抗血管生成和促凋亡作用。NK細胞療法主要有兩種形式:一種是在體內利用患者自身的NK細胞,通過注射抗體或施用檢查點抑制劑來對抗腫瘤;另一種是過繼轉移,即在體外擴增和啟動同種異體來源的NK細胞,然後輸注回患者體內。
NK細胞療法的優勢
1.免疫細胞治療是繼手術、化療和放療之後的第四種治療方法。NK細胞治療配合放化療,可以有效清除手術不能完全切除的腫瘤細胞;
2.NK細胞治療聯合放化療,可以提高放化療的療效,降低副作用;
3.對於不適合做手術或者放化療的晚期癌症患者,NK細胞治療是其較好的選擇;
4.術後定期採用NK細胞治療,可以預防癌症的復發和轉移;
5.減緩癌性疼痛,改善睡眠,提高患者生命品質,延長患者的生命週期;
6.亞健康人群,採用NK細胞治療可以降低患癌風險。
與傳統治療方式相比較,NK細胞免疫療法側重利用人體自身的免疫機制,對復發、難治性腫瘤患者表現出突破性療效。
NK細胞治療癌症的臨床進展
近年來,已經有許多癌症的治療研究採用了NK細胞。截至2020年6月,NK細胞治療的臨床研究761項,主要分佈在東亞196項、美國213項、北美219項。涵蓋了急性髓系白血病、神經母細胞瘤、惡性膠質瘤、B細胞淋巴瘤、肝癌、、膽管癌等。同時,NK細胞療法也開始成為資本市場競爭的新焦點。例如,全球製藥巨頭企業賽諾菲斥資3.08億歐元加入了NK細胞療法賽道,收購了開發NK細胞療法的生物技術公司Kiadis。20年前,NK細胞介導的免疫療法就被認為是晚期白血病患者的一種安全有效的治療方法。近年來,以NK細胞為基礎的癌症治療領域呈指數級增長,目前已成為免疫治療創新的主要領域。
健康人的NK細胞殺傷力更強
正常人每天會新陳代謝數千萬個細胞,健康人的NK細胞免疫功能足夠強大,可以及時清理癌變的細胞。但對於癌症患者來說,一方面,腫瘤的生長阻礙了NK細胞在骨髓內的分化、成熟;另一方面,因為癌細胞的侵害,身體中殘存的NK細胞戰鬥力極弱,普遍存在免疫功能低下、不能有效識別、殺滅癌細胞的情況。所以,健康時的NK細胞比得病時的細胞活性更強、殺傷力更勝一籌。
個體從接觸危險因素到體內出現癌變需要5-20年的時間,在這個期間NK細胞與體內的癌細胞“此消彼長”,不斷“博弈”,發生著對抗。NK細胞隨著時間推移活性、殺傷力和數量會受到癌症的影響不斷下降,癌症中、晚期患者的NK細胞往往已經發生嚴重的受損,無法消滅腫瘤細胞,造成癌症的復發和轉移。
對作為守衛機體健康的NK免疫細胞功能的不斷深入研究,也為治療癌症提供了一個契機——通過細胞工程的方法恢復或者重建NK細胞抗腫瘤的能力,提高NK細胞對腫瘤免疫治療的效果;或通過體外擴增、啟動並儲存健康時的NK細胞,一旦腫瘤發生就可以利用健康的NK細胞來提高腫瘤的治癒率、減少患者的死亡率。未來,隨著在多個腫瘤領域的研究滲透,NK細胞有望給更多的患者帶來新的選擇。
CAR-NK 細胞,有前途的免疫細胞療法【東方財富網】
近年來,創新的免疫療法為血液系統惡性腫瘤的治療提供了新的策略。與傳統的化學療法不同,將T細胞通過基因工程改造,使它們能特異性對腫瘤細胞產生細胞毒性,與之相關的成功案例令人震驚。然而,仍有許多問題——包括療效不足、自體來源不足、副作用大、價格高——從而限制了臨床上的使用。
CAR-NK細胞是一個有希望的替代方案,它具有獨特的細胞毒性和最小的移植物抗宿主病風險。在本文中,我們回顧了CAR-NK 細胞領域的可能來源、開發技術、潛在優勢和面臨的挑戰。嵌合抗原受體工程 T 細胞 (CAR-T) 的免疫療法徹底改變了復發/難治性 B 細胞惡性腫瘤的治療範式。但儘管如此,自體T 細胞的使用仍具有一定的局限性,包括收集的效應T細胞質量的異質性、細胞處理時間較長、可用的CAR細胞數量有限、以及成本高。
考慮到在單倍體造血幹細胞移植和針對實體瘤及血液惡性腫瘤的過繼性細胞療法中的抗腫瘤作用,NK細胞可能是一種有前途的替代品。NK細胞有不同來源,可通過臍帶血、外周血和誘導多能幹細胞技術獲得。它們最大的優勢是可以同種異體應用而不會產生重大的毒副作用。然而,大多數關於CAR-NK細胞的報告都處在臨床前或早期臨床試驗階段。事實上,NK細胞可能更難以設計,需要優化擴增和轉染方案,使其標準化。此外,它們在輸注後的療效的持久性也是一個難題。
隨著利用其細胞溶解能力、抗體依賴性細胞毒性 (ADCC) 和細胞因數誘導製造CAR-NK細胞的最新進展,“現貨”同種異體CAR-NK細胞有望在癌症治療中大放異彩。
NK細胞生物學
豐富的受體和免疫自我耐受與免疫監視之間的平衡
自然殺傷 (NK) 細胞是一種特定類型的淋巴細胞,被認為是先天免疫的一部分,占淋巴細胞總數的10%至15%。它們在惡性細胞和病毒感染細胞的免疫監視中起著至關重要的作用 [1]。NK 細胞主要通過細胞毒性發揮作用:通過分泌穿孔素/顆粒酶以產生“天然”的細胞毒性誘導細胞凋亡,以及 FasL(Fas 受體的配體,或CD95,腫瘤壞死因數)或TRAIL等因數的表達(TNF相關的凋亡誘導配體),通過啟動死亡受體誘導細胞凋亡;還有由 Fc 受體 CD16 (FcRIII) 介導的抗體依賴性細胞毒性 (ADCC)。
此外,NK細胞產生許多細胞因數,最顯著的是干擾素和TNF。由於其卓越的裂解能力,以一種不依賴抗原的方式進行預啟動,所以引起不良反應的概率較低。事實上,NK細胞的活性是由啟動和抑制信號的複雜整合來調節的——是它們表面上的眾多受體與靶細胞表面上的不同配體之間相互作用的總和(圖1)。
NK細胞有兩個亞群組成,CD56 dim 和 CD56 bright NK 細胞,由其CD56的表達強度而定義。CD56 dim細胞約占血液NK細胞的90%,具有很強的細胞毒性,主要表達CD16。CD56 bright NK 細胞占迴圈血液中NK細胞的 10%,但主要存在於淋巴結和一些其他器官中,它們的CD16表達較低,細胞毒性能力低於 CD56 dim,但具有強大的增殖潛力。這些特性和功能上的差異對於增強NK細胞在細胞治療中的使用和操作非常重要。
同種異體NK細胞
在單倍體幹細胞移植中的抗白血病作用
無論使用何種化療或放療方案,許多血液系統惡性腫瘤僅靠化療和放療仍是無法治癒的。同種異體造血幹細胞移植(HSCT)是當今大量血液癌症的唯一治癒選擇。在同種異體HSCT中,主要目標是用同種異體供體的正常造血功能對患者的免疫系統進行代替。供體對受體的免疫系統反應稱為移植反應。這種反應,簡稱 GvL,表示移植物抗白血病/淋巴瘤,能夠消除患者體內殘留的惡性細胞,並在較長時間內控制血液惡性腫瘤。這種理論上理想的解決方案的主要挫折是嚴重的副作用:移植物抗宿主病(GVHD)。供體的免疫系統——本質上是同種異體反應性T淋巴細胞——攻擊宿主的健康組織(尤其是皮膚、消化道、肝臟和肺,但任何器官都可能受到影響)。為了限制嚴重 GVHD 的風險,大多數同種異體 HSCT 是由 HLA 相同的供體進行的,因此供體和受體之間的 HLA 需完全匹配。
在這種特殊情況下,可以考慮啟動來自供體的單倍體NK細胞。事實上,受體白血病細胞表面的某些I類HLA分子(=KIR配體)可能不被供體NK細胞上的抑制性KIR受體識別。這種現象被稱為 GVL NK效應,由 KIR/KIR配體錯配介導。
這一概念已在先前的研究中報導,通過這種錯配來發揮抗白血病作用,尤其是在 AML 環境中移植了半相合供體的患者中[7,8]。然而,同種異體 HSCT 後同種異體反應性 NK 細胞的這種抗白血病作用是有爭議的,一些研究顯示出相互矛盾的結果。毫無疑問,具有重要可塑性的 NK 細胞會適應其環境或存在移植後成熟延遲,從而降低其效力和細胞毒性 [9,10]。儘管如此,即使NK細胞的體內作用不如T細胞的作用那樣得到了充分證明,但自1990年代後期以來,半相合HSCT的發展有助於闡明這一特定淋巴細胞群,並進一步利用它具有巨大的抗腫瘤細胞毒性的潛力 [11,12]。
CAR-T免疫療法
迄今為止,同種異體 HSCT 是最古老和最常用的抗白血病免疫療法。然而,它確實構成了一種激進的(接受者的免疫系統被破壞並被捐贈者的免疫系統取代)、非特異性、非靶向免疫療法,這解釋了它的主要毒性——尤其是GVHD風險,在中斷細胞移植後數月或數年對患者的免疫系統仍有持續影響。嵌合抗原受體 (CAR) T 細胞的發展以前所未有的方式徹底改變了細胞抗腫瘤免疫療法 [13 , 14 , 15 , 16 , 17 , 18 , 19]。
CAR是一種將常規T細胞,經過基因工程改造以表達靶向抗原的特定受體。這種嵌合受體由能夠特異性識別靶細胞上抗原的免疫球蛋白 (scFy) 的細胞外單鏈可變片段、跨膜結構域和用於信號傳導的細胞內結構域組成,由細胞質 CD3 信號傳導組成使 CAR 的啟動獨立於 pMHC(第一代 CAR)的結構域,其中注入 CD28或4-1BB共刺激結構域以增強機械轉導(第二代CAR),或結合兩者(第三代 CAR)或與另一個轉基因相關的單個共刺激結構域以提高細胞因數的表達,從而促進 CAR-T 細胞效應器能力(第四代)。EMA(歐洲食品與藥品監督管理局) 已批准在R/R DLBCL[20] 中使用axicabtagene ciloleucel和 tisagenlecleucel,以及在患有B-ALL的年輕成人中使用 tisagenlecleucel。其他自體抗CD19或抗BCMA CAR-T細胞可早期用於成人ALL、濾泡性NHL和骨髓瘤。
通過這些創新的新療法,可以觀察到40-60%的患者的長期反應,這些患者的中位總生存期通常約為6個月,從而徹底改變了這些難治復發性血液系統惡性腫瘤的治療格局 [21 , 22 , 23]。然而,CAR-T療法在使用上仍面臨諸多障礙和實際問題[24]。
(1)CAR-T細胞是從患者自身的自體細胞發展而來的,在淋巴采血過程中收集到的T淋巴細胞的品質以及獲得的產品的異質性(如效應能力、活力、擴增能力、T細胞衰老和耗竭),本質上是由之前的治療引起的,也是患者的免疫系統狀態所致;
(2)從收集到生產過程的這些障礙使製造過程費力、漫長且非常昂貴;如今,在美國,單個B 細胞淋巴瘤患者的 CAR-T 細胞治療費用平均為 373,000 美元。Prime Therapeutics 使用真實資料進行的一項新研究發現,總成本平均超過 700,000 美元,在某些情況下,CAR-T移植後續費用可能超過 100 萬美元。在法國,在社會保險涵蓋CAR—T手術的全部費用的情況下,CAR-T 治療的價格約為 350,000 歐元,不包括住院和輔助治療的價格。CAR-T 細胞的生產和輸注之間的延遲可能達到2個月,這對於患有難治性不受控制的血液系統惡性腫瘤的患者來說太長了。
(3)此外,注射的抗CD19 CAR-T細胞有其自身的毒性造成的副作用——最常見的是炎症與細胞因數釋放綜合征 (CRS) 或神經和血液損傷(例如,血細胞減少症,有時可能持續存在)的發展有關。最後,CAR-T治療後抗原靶點的丟失是一個重要的復發原因,尤其是在CD19 B ALL中[25]。
其他基因改造——例如TCR抑制或引入自殺基因——是必要的;一些研究人員甚至嘗試使用沒有排斥或GVHD的雙陰性CAR-T 細胞 (CD4-CD8-) [26]。一些臨床研究正在進行中,以測試這些同種異體CAR-T 細胞(主要用於 B 型惡性腫瘤)與通常的氟達拉濱-環磷醯胺 (FluCy) 淋巴耗竭,其中添加了阿侖單抗以降低免疫排斥的風險。該工藝增加了CAR的毒性特徵,卻隨之增加了免疫抑制甚至長期發育不全的風險。在 UCART19 小組最近的一項試驗中,在使用或不使用阿侖單抗的FluCy調理後,將基因組編輯的、供體來源的同種異體抗CD19 CAR-T細胞給予患有難治性 B-ALL的成人和兒童。只有接受阿侖單抗的患者表現出擴張和抗白血病活性,輸注後28天的CR率為67%,但主要代價是高毒性[27]。今天,同種異體CAR-T細胞最常見的用途是作為同種異體 HSCT 的橋接——尤其是在AML和髓系腫瘤中。
CAR-NK細胞免疫療法
NK細胞的活性完全獨立於抗原和HLA;它們可以從不相關的同種異體HLA不相容的供體中獲得。供體NK細胞和受體腫瘤細胞之間的這種HLA不相容性可通過 KIR/KIR 配體錯配促進NK細胞的抗腫瘤同種異體反應(見第1節)。有趣的是,與同種異體T細胞不同,NK細胞不會引起任何GVHD。這種現象的原因尚不完全清楚,但啟動劑受體可能是關鍵。健康的非應激(例如,皮膚、消化道)宿主組織在其表面上不存在應激誘導的配體,從而使它們免受NK細胞毒性的影響。在 HLA不相容的小鼠HSCT模型中,供體NK細胞甚至通過破壞受體的抗原呈遞細胞對GVHD發揮保護作用。這種對接受者免疫系統的影響可以促進移植並使同種異體NK細胞不易受到免疫排斥的影響。
“現貨”的同種異體NK細胞在從實驗室到床旁的效率,以及成本方面呈現出巨大的優勢 [24 , 28 , 29] (表1 )。儘管CAR-NK細胞具有所有這些優勢,但仍存在一些局限。
(1)首先,它們在體內的存活時間相對較短,約為1-4周。在難治性AML患者的家族性半相合供體的短期(12-16 小時)IL-2 啟動 CD3-CD56+NK細胞的臨床試驗中,表明用氟達拉濱和環磷醯胺清除淋巴對NK細胞的擴增至關重要,並且IL-15的存在是擴增和臨床反應的預測因素 [30]。NK細胞的體內擴增也需要體內施用IL-2,具有顯著的毒性作用。在CAR-NK細胞的構建中加入細胞因數轉基因(如 IL-2 和 IL-15)具有改善擴增效率和持久性的潛力 [28]。
(2)其次,血液中數量有限的NK細胞需要離體擴增技術,以便在收穫後使用單采術獲得必要的劑量。已經研究了用於離體擴增和啟動NK細胞的不同方法。這些方法包括用細胞因數(主要是 IL15 和 IL2)培養數天(通常為14 天)。IL-2是必不可少的,目前用於促進同種異體NK細胞遞送後的NK細胞擴增,而IL-15在NK細胞發育和體內平衡中起關鍵作用。一些報導中使用飼養細胞如Jurkat T淋巴母細胞或Epstein-Barr病毒轉化的淋巴母細胞系 (EBV-LCL) 大規模擴增NK細胞。K562 是一種白血病細胞系,經過基因改造,可表達膜結合形式的IL-15和4-1BB(CD137L)。最近,K562 細胞已被設計為表達膜結合的IL-21和CD137L,展示了一些有趣的結果。
關於哪種方法最適合NK 細胞的高效擴增仍然存在爭議,有研究發現K562飼養細胞能夠誘導強勁和持續的增殖(培養3至5周後擴增100至 >10,000倍)[31]。
(3)第三,NK細胞改造有一定難度,對細胞凋亡高度敏感且基因表達水準低。目前,將基因引入NK細胞的最成功的替代方法是通過電穿孔快速暫態表達,或通過病毒載體持續但低表達。因此,轉染方案的優化仍然是開發CAR-NK療法的一個重要因素 [32]。最近,在離體擴增環境中對原代人自然殺傷細胞的慢病毒轉導進行了改進。優化基因工程NK細胞方法將促進CAR-NK細胞的廣泛應用 [33]。
(4)最後,腫瘤微環境 (TME) 降低了血液惡性腫瘤中NK細胞的代謝活性,構成了增強NK細胞抗腫瘤作用的重要障礙[34,35]。與摻入IL-15的方式相同,使用編碼趨化因數受體的轉基因可以促進CAR-NK在腫瘤部位的運輸。與抗PD1/抗PDL1等檢查點抑制劑聯合使用有助於克服TME的抑制作用,從而釋放CAR-NK細胞的全部潛力。這種效果在小鼠模型的臨床前研究中似乎是成功的,但仍需要在患者的臨床研究中得到證明 [36 ,37,38]。還需要注意的是,關於被CAR細胞阻斷的檢查點的大部分數據都來自CAR-T細胞的經驗,而對CAR-NK細胞的經驗很少。
CAR-NK細胞的來源
同種異體CAR-NK細胞的一個主要優勢是隨用隨取,這依賴於良好的凍存工藝,隨後才有可能從特定的細胞源產生大量的同質批次。許多NK細胞來源已被用於生產同種異體CAR-NK細胞。
NK-92細胞系
NK-92是一種白細胞介素2依賴性、EBV 陽性自然殺傷細胞系,來源於一名患有快速進展性非霍奇金淋巴瘤的 50 歲白人男性的外周血單核細胞,它們具有高度細胞毒性。它們的表型包括啟動受體 NKp30、NKp46和NKG2D。有趣的是,NK-92表面上唯一的抑制性受體由 ILT2、CD94-NKG2A(識別HLA-E)和表達水準較低的抑制性KIR受體KIR2DL4代表。它們的使用非常方便,因為理論上可以批量生產和“無限”生成CAR-NK細胞,在細胞數量、時間和成本方面都有巨大的收益。不過由於它們的腫瘤性質,這些源自NK-92細胞系的CAR-NK細胞需要在注射前進行照射,從而改變它們的壽命和分裂。儘管受到照射,它們似乎保留了它們的細胞毒能力,但它們的體內增殖能力發生了急劇變化,注射後7天內消失,需要多次注射。
在三名淋巴清除化療後復發和難治性AML患者中,已經報導了在人類患者中使用CAR-NK細胞的一些證據,這些患者的 CD33-CAR-NK 細胞來源於 NK-92細胞系[39]。這三名患者接受了挽救性化療,然後以增加的劑量注入抗 CD33 CAR-NK細胞(每位患者使用三個遞增劑量的輻照 CAR-NK-92細胞)。每名患者安全應用多達 5×109個 CD33-CAR-NK 細胞,沒有明顯的副作用或3-4級毒性;只報告了短暫的發燒。然而,即使治療耐受性良好並且重複輸注的安全性得到證實,所獲得的療效反應也非常短暫,一名患者只有10天,另一名患者最多4個月 [39]。
在體外,慢病毒CD33-CAR載體在NK-92細胞中的效率遠高於90%,但細胞毒性試驗表明,與親代NK-92細胞相比,對人 HL-60早幼粒細胞白血病細胞系的細胞毒性適度增強[39]。CAR-NK-92細胞也已針對多發性骨髓瘤細胞進行了探索。江等人報導了用抗 CD38 轉導的NK-92細胞在體外以及在異種移植 NOD-SCID 小鼠模型中,對骨髓瘤細胞系和原發性骨髓瘤細胞具有很強的抗腫瘤活性 [40],用表達抗 CS1/SLAMF7 CAR的NK-92 細胞觀察到類似的結果 [41]。
為了提高源自NK-92細胞系的CAR-NK細胞的效率,最初用於T 細胞的第4代CAR在一個名為 UniCAR 的平臺上生產。UniCAR 系統由兩個元素組成:
(i)針對肽表位 E5B9 的 CAR-NKG2——一種非天然在細胞表面表達的抗原;
(ii) 稱為目的模組 (TM) 的雙特異性組件。這種雙特異性模組在一側表達 E5B9 抗原,另一側表達對腫瘤抗原特異的抗體(圖 2)。該構建體使 CAR-NKG2 細胞(通過E5B9抗原)和靶細胞(通過特異性抗體)之間能夠接觸。除此之外,效果可以立即停止(開/關效果),因為 TM 的壽命很短。一旦停止TM的穩定(連續)輸注,TM就會被淘汰,UniCAR也會失活。事實上,該系統通過改變可以同時或以順序方式給予的TMs來實現大量腫瘤抗體的靶向選擇 [42]。
源自臍帶血的 NK 細胞
臍帶血是NK細胞的豐富而有趣的來源,因為國際血庫有數十萬個臍帶血 (UCB) 單位可供使用。NK細胞占臍帶淋巴細胞的15%至 30%。它們的表型比成人外周血細胞的表型更不成熟,具有非常特殊的特徵,包括低CD16(低ADCC能力)、CD56 bright(比細胞毒性更具有增殖能力)、NKG2A+(一種抑制性受體,識別 HLA-E)和低 KIR(功能比其對應物少)[43]。然而,這些限制可以通過使用細胞因數和轉染的離體擴增和啟動來克服,並且根據筆者的經驗,與來自血細胞的 CAR-NK 相比,來自臍帶血的 CAR-NK 細胞在流式細胞術中觀察到具有相同的啟動特徵。即使 UCB 中的 NK 細胞或多或少稀少,它們也具有非常重要的增殖能力,並且對細胞因數刺激非常敏感,可以進行離體擴增。
由 Tezvani 等人帶領的 MD Anderson 團隊。最近發表了一項非常令人鼓舞的 I/II 期臨床試驗,該試驗在 11 名患有復發性難治性 B 細胞惡性腫瘤(從非霍奇金淋巴瘤到慢性淋巴細胞白血病)的患者中注射來自新鮮 UCB 的CAR-NK-CD19 細胞(ClinicalTrials.gov ,NCT03056339)(圖3)。用研究中使用的三種劑量之一(1×105、1×106或1×107每公斤細胞數)在淋巴清除化療(氟達拉濱和環磷醯胺)後。
值得注意的是,UCB NK細胞輸注後沒有注意到不良反應或毒性,特別是CRS 或神經毒性,試驗中未達到最大耐受劑量。反應在注射後的第一個月迅速出現,在11名受試者中,有7名患者完全緩解,並在 Richter 轉化中恢復到CLL狀態。儘管如此,重要的是要展示一個事實,即一半的患者在注射NK細胞後接受了維持治療,由來那度胺、利妥昔單抗、維奈托克或HSCT組成的綜合方案。在注射後長達12個月內檢測到NK細胞。最有可能的是,在 CAR結構中添加IL-15基因有助於CAR-NK細胞的長期存活,儘管持久性機制尚未闡明。
此外,一個可能且非常重要的技術挫折是直接從新鮮UCB生產 CAR-NK細胞,以及在生產後立即注射,沒有任何凍存步驟。事實上,由於從冷凍保存的細胞中選擇NK細胞的效率低,可能不應該推薦使用來自國際銀行的冷凍保存的臍帶血來生產CAR-NK細胞。根據 MD Anderson 團隊的經驗,從新鮮臍帶血中擴增可能是一種選擇——或者更確切地說,建立選定的冷凍保存的NK細胞庫,這些細胞可以解凍和擴增以進行轉導。還應注意的是,CAR-NK細胞在冷凍保存後活性有所降低,在目前的技術條件下,CAR-NK細胞應在培養後立即給藥。即使CAR-NK細胞的具體長期療效難以評估,並且該工藝在冷凍細胞上的可行性尚待確定,但結果非常有希望[44]。
來自外周血的NK細胞
如前所述,大多數採用過繼性NK療法(不包括CAR-NK細胞)的研究都使用了來自單倍體相關或不相關供體的細胞,並已在兒童和成人AML中顯示出抗腫瘤反應 [29,46]。然而,缺點是需要從健康的成年志願者那裡收集細胞,這使得該過程比使用UCB稍微複雜一些。在細胞因數存在的情況下,一些簡單的、符合GMP的培養條件可以將它們的擴增提高25-55倍 [49]。如果來自PB的NK細胞與CB NK細胞相比具有高細胞毒性,那麼在CAR-NK療法的背景下,供體在HLA不相容性方面的選擇是否應該有所不同仍有待證明。
Leivas 等人的團隊描述了一種可以使用和衍生自PBMC的方法[53]。在活化和擴增的NK細胞 (NKAE) 和記憶T細胞 (CD45RA-T 細胞) 之間選擇效應細胞。NK或T細胞在與NKG2D-4-1BB-CD3z-CAR 載體一起培養後轉導,使用在NK和T細胞上表達的 NKG2D 啟動劑受體,以及用於轉導的4-1BB(見上文)。NKG2D 具有特定的配體,包括 MICA、MICB 和 ULBP,它們在應激細胞和許多腫瘤細胞上表達,特別是在多發性骨髓瘤中。在體外,記憶T細胞的轉導比其NK對應物更穩定。然而,CAR-NKAE細胞在體外對MM細胞表現出更強的細胞毒性,同時保護健康細胞免受損傷。此外,在他們的小鼠異種移植骨髓瘤模型中,與T細胞相比,CAR-NKAE細胞表現出高效的細胞毒性和增強的抗骨髓瘤活性。
另一種方法是使用 Cas9/RNP 和腺相關病毒基因遞送的 CRISPR 靶向 CAR 基因插入。使用這種技術,產生了具有不同跨膜和信號結構域(CD4/4-1BB+CD3 和 NKG2D/2B4+CD3)的靶向 CD33 的CAR-NK,並且似乎在原代NK細胞中顯示出增強的抗 AML活性 [54]。
源自 iPSC 的 NK 細胞
誘導多能幹細胞 (iPSC) 是經過基因重程式設計成為多能幹細胞的分化細胞。成熟分化細胞重程式設計為 iPSC 的過程包括對細胞進行基因改造,使其表達四種基因:Klf4、C- myc、Oct3/4和Sox2,從而具有與胚胎幹細胞相同的特徵。 因此,分化的成人重程式設計細胞獲得了無限增殖的潛力,並且在加入特定生長因數後可以分化成任何細胞類型,這使得它在許多醫學領域都有用武之地——特別是再生醫學、細胞療法或遺傳病的模型化。這一發現獲得了 2012 年諾貝爾醫學獎,授予神戶大學(日本)研究員山中伸也 [55]。
由於它們的永生特性,單個iPSC足以生產和生成通用的 CAR-NK“現貨”產品。由iPSC產生的NK細胞具有不成熟的表型,具有低CD16、高 NKG2A和低KIR,具有較差的細胞毒性,但具有非常重要的增殖能力。為了增強它們的細胞毒性並使其持久存在,可以添加用於表達CD16 和 IL-15 或 IL-2的基因 [56, 57]。
FT596產品是第一個“即用型”、通用和同種異體CAR-NK細胞產品,源自iPSC技術,並且已經獲准在美國用於臨床研究 [58]。它由針對NK細胞優化的抗CD19 CAR組成,具有啟動劑受體 NKG2D的跨膜結構域、2B4共刺激結構域和 CD3 信號傳導結構域。添加了兩個關鍵成分:
(i) 一種新型、高親和力、不可切割的 CD16 Fc 受體 (hnCD16),可在沒有負調控的情況下實現腫瘤靶向和增強抗體依賴性細胞毒性,並結合靶向治療性單克隆抗體腫瘤細胞;
(ii) 促進細胞因數非依賴性持久性的 IL-15/IL-15 受體融合蛋白 (IL-15RF)(圖 4)。當與利妥昔單抗(抗CD20)等單克隆抗體聯合使用時,FT596的hnCD16 Fc受體與覆蓋腫瘤細胞的單克隆抗體的Fc部分結合,啟動NK細胞,分泌細胞因數,增強ADCC。IL-15RF促進NK細胞和活化的抗腫瘤 T 細胞的細胞毒性。
ASH 2020期間的一份通訊報導了一名76歲女性在接受八線治療(包括 ASCT、自體過繼 T 細胞治療和活化的半相合NK細胞)後復發難治性 DLBCL 的病例 [59]。
該患者在淋巴清除單藥治療後接受了獨特劑量的30×106 FT596 細胞。除了中性粒細胞減少症外,沒有報告與FT596細胞相關的副作用。在1個月閾值的腫瘤反應評估顯示基於 2014 Lugano 標準的部分反應,18 F-Glu 吸收減少超過70%,腫瘤大小減少超過 50%。該患者的第二劑 FT596 正在進行中。一項 I 期研究也在進行中,估計有 285 名患者入組(clinicaltrials.gov:NCT04245722)。
結論
同種異體 CAR-NK 細胞提供了許多有趣的視角,可以解決使用自體CAR-T細胞所面臨的一些問題。迄今為止,同種異體NK細胞面臨的主要挫折是它們相對較短的作用持續時間,以及缺乏標準化工藝。與CAR-T細胞相比,CAR-NK細胞療法在很大程度上屬於起步階段;截至2022年5月1日,共有35項試驗涉及CAR-NK細胞,與臨床試驗網站上涉及CAR-T細胞療法的1181項試驗相比,證實了這種創新療法的資料較少。CAR-NK細胞療法在抗擊癌症方面具有廣闊的前景,但仍需更多研究加以論證。