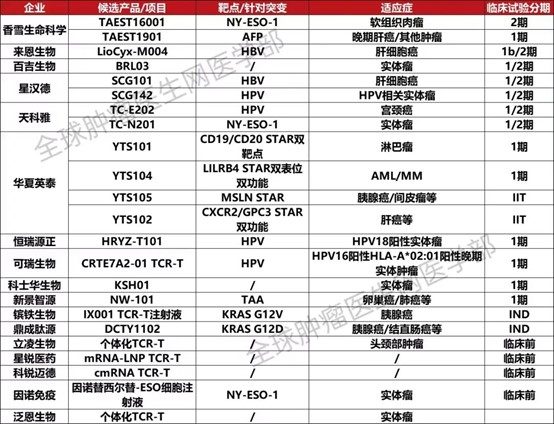
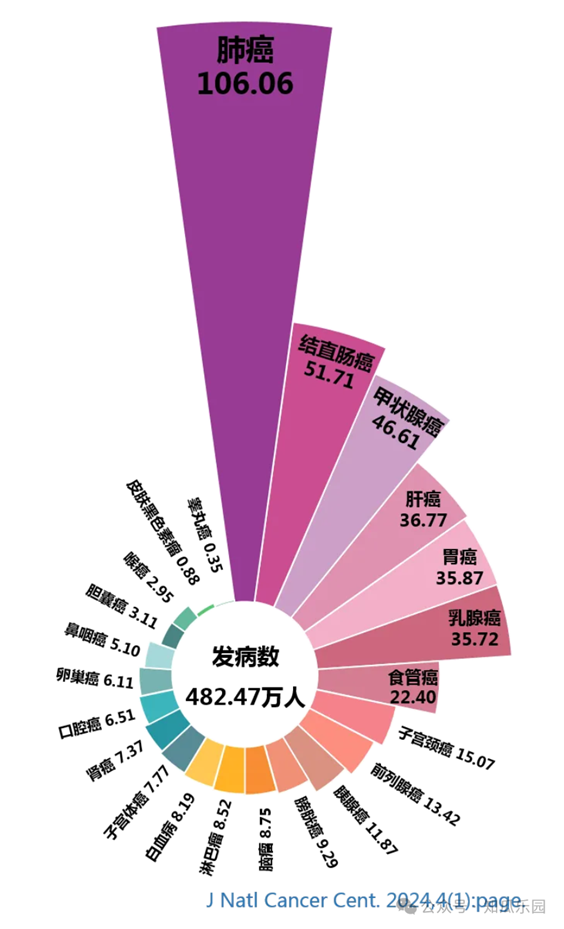
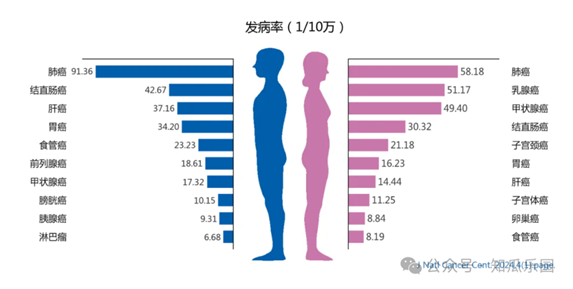
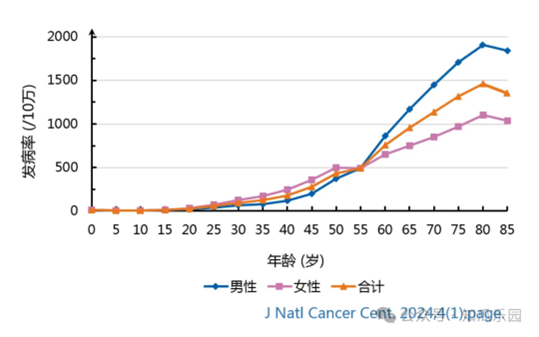
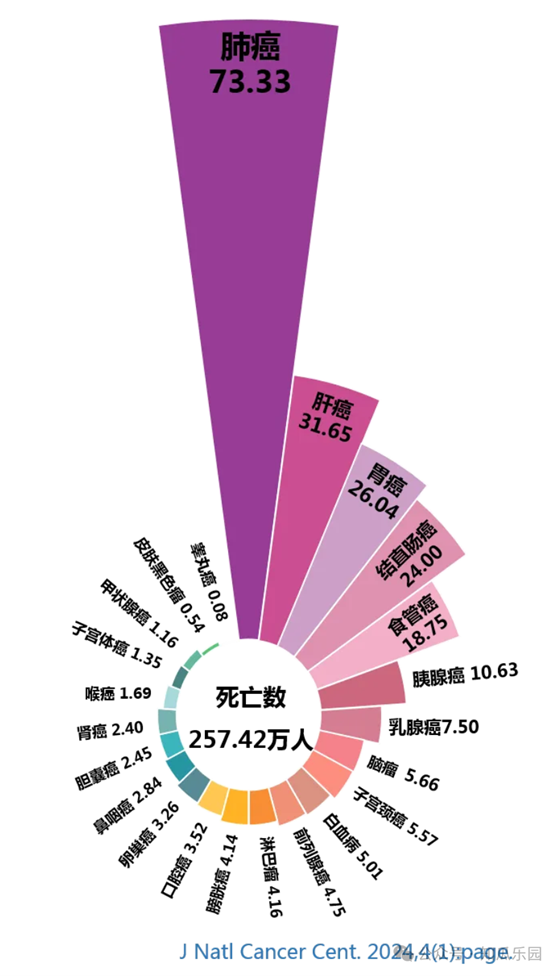
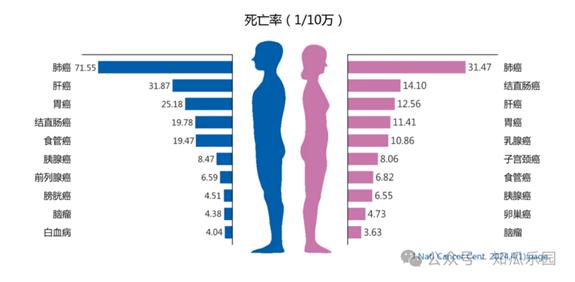
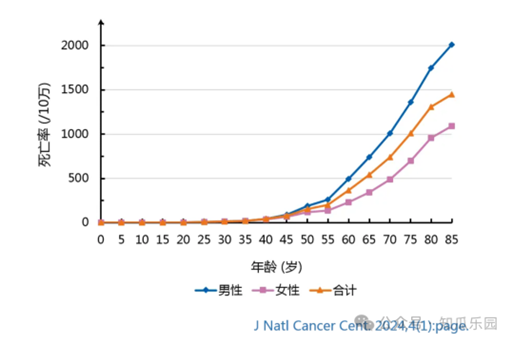
腫瘤是困擾現代醫學的棘手難題。儘管放療、化療和手術等治療方式在控制和治療某些惡性腫瘤方面取得了一些成功,但腫瘤治療仍面臨多重複雜困境,例如缺乏特異性治療及個體化治療手段、治療不良反應較多、腫瘤異質性和腫瘤耐藥等。隨著細胞生物學和免疫學的發展,細胞治療作為一種新興的腫瘤治療策略正在迅速崛起。
走進細胞治療
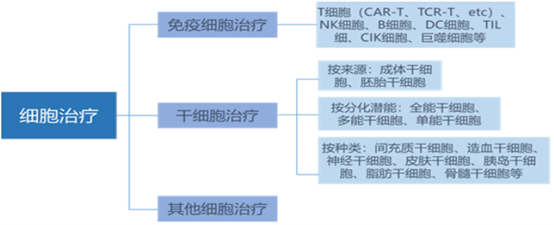
隨著人類醫學技術的不斷進步,當代醫學領域逐漸由分子治療轉向細胞治療。細胞治療是指利用患者自體(或異體)的成體細胞(或幹細胞)對組織、器官進行修復的治療方法。廣泛用於骨髓移植、晚期肝硬化、股骨頭壞死、惡性腫瘤、心肌梗死等疾病。目前主要的細胞治療方式分為免疫細胞治療和幹細胞治療。
資料來源:中國腫瘤生物治療雜誌
細胞治療技術—生物醫藥領域的一大破曉之光
細胞治療技術正以其獨特的治療機制和巨大的潛力引起全球科學界的關注。這一技術通過轉移和植入特定的、經過篩選或改造的活細胞,直接對疾病進行治療,它代表了從治療症狀到修復病因的根本性轉變。
細胞治療在技術創新的推動下進入快速發展時代。1990s開始,科學家開始研發CAR-T,並且不斷改進CAR結構;2017年美國FDA批准全球首款CAR-T產品上市;2021年,中國NMPA批准兩款CAR-T上市;2022年2月,中國藥企研發的CAR-T產品Ciltacel成功在美國上市銷售。無論是利用幹細胞的再生能力修復受損組織,還是通過免疫細胞治療來強化身體對抗惡性腫瘤的能力,細胞治療都在為我們打開一扇通往未來醫學治療的大門。
幹細胞治療
幹細胞治療是指應用人自體或異體來源的幹細胞經體外操作後輸入(或植入)人體,用於疾病治療的過程,這種體外操作包括幹細胞的分離、純化、擴增、修飾,以及幹細胞(系)的建立、誘導分化、凍存和凍存後的復蘇等過程,可分為ESC、ASC和iPSC三種藥物類型。
自2018年CDE重新受理幹細胞新藥臨床試驗申報以來,中國幹細胞藥物臨床試驗申請數量呈現逐年增長趨勢。2022年《幹細胞臨床研究管理辦法(試行)》等系列政策的出臺,進一步加速幹細胞臨床轉化。
免疫細胞治療
免疫細胞治療可以將人體的免疫細胞改造成“活的”藥物,在癌症、傳染病、神經系統疾病等複雜、難治性疾病的治療中扮演重要角色。2023年9 月,嵌合抗原受體T細胞(chimeric antigen receptor T cell, CAR-T) 療法的“開拓者”賓夕法尼亞大學Carl June 教授和紀念斯隆-凱特琳癌症中心Michel Sadelain 教授獲得了素有“科學界的奧斯卡”之稱的科學突破獎(Breakthrough Prize),可見該領
域在全球生物醫藥領域的重要地位。
免疫細胞治療可分為工程化免疫細胞療法和非工程化免疫細胞療法。工程化免疫細胞療法通過工程化改造免疫細胞,使其可識別受疾病影響的組織並發揮作用,包括CAR-T療法、T細胞受體嵌合T細胞(T cell receptor-gene engineered T cell, TCR-T)療法、嵌合抗原受體自然殺傷細胞(chimeric antigen receptor natural killer cell, CAR-NK) 療法等 ;非工程化免疫細胞療法是指未經修飾的免疫細胞,主要利用其固有的細胞毒性發揮作用,包括調節性T細胞(regulatory T cell, Treg) 療法、腫瘤浸潤淋巴細胞(tumor infiltrating lymphocytes cell, TIL) 療法、細胞毒性T細胞(cytotoxic T cell, CTL)療法等。
嵌合抗原受體T(CAR-T)細胞療法是免疫細胞治療中的一種新興的腫瘤治療手段,通過基因工程技術改造T細胞,使其具備特異性識別和殺傷腫瘤細胞的能力,已在臨床應用中取得了顯著成果。此外,工程化T細胞受體T(TCR-T)細胞、腫瘤浸潤淋巴細胞(TIL)、NK細胞、細胞因數誘導的殺傷(CIK)細胞等細胞療法的研究也引起了廣泛的關注,在腫瘤治療領域顯示出良好的前景。近年來,隨著基因編輯等生物學技術的飛速發展,免疫細胞治療也迎來了高速發展期,國際上CAR-T、TCR-T細胞等療法新註冊臨床試驗項目也隨之大幅提升。
圖2 2003-2024年新註冊的免疫細胞治療腫瘤臨床試驗專案
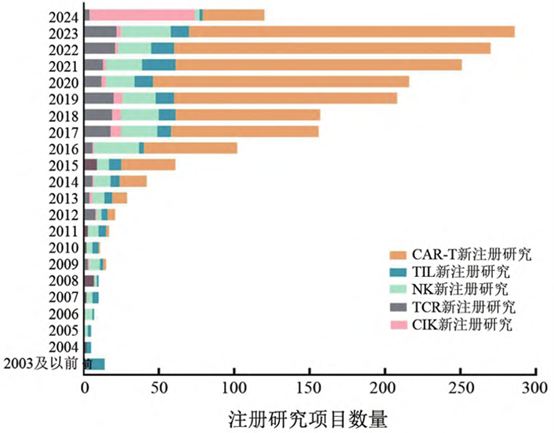
資料來源:中國腫瘤生物治療雜誌
細胞治療臨床研究轉化
隨著免疫細胞治療領域技術的不斷成熟與臨床規範性的不斷提升,免疫細胞治療產品的臨床與轉化應用進程持續加快。
根據Cortellis資料庫顯示,截至2023年底,共有861件免疫細胞治療產品進入臨床試驗階段,其中有511件為CAR-T細胞治療產品,占其中的59.3%,臨床應用的深入為新產品的產業化提供了重要支撐。
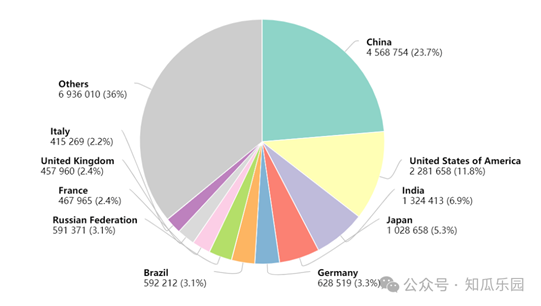
從臨床試驗開展的國家或地區來看,截至2023 年底,在中國與美國開展免疫細胞治療臨床試驗的藥物數量遠超其他國家,其中,在中國開展臨床試驗的免疫細胞治療藥物431件,全球占比50.1%,位居首位;在美國開展臨床試驗的免疫細胞治療藥物390件,全球占比45.3%,位居第二 。
表1 2023年全球免疫細胞治療臨床試驗國家或地區分佈
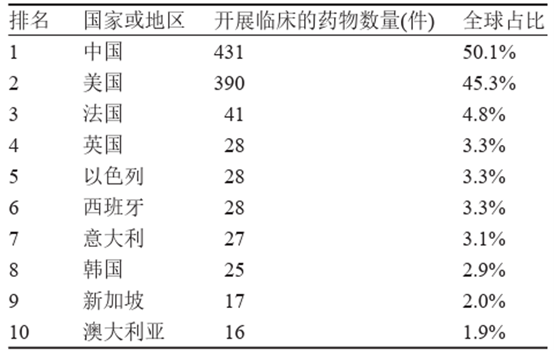
資料來源:Cortellis資料庫
從臨床試驗階段來看,免疫細胞治療產品臨床試驗主要處於臨床Ⅰ期和Ⅱ期,其中臨床Ⅰ期450件,臨床Ⅱ期341件,臨床Ⅲ期16件。值得注意的是,基於免疫細胞治療類產品相比于傳統化學藥與生物藥的特殊性,大多臨床試驗通過進行Ⅰ/Ⅱ期合併臨床試驗以加速研發進程,因此,各個研發階段藥物數量的總和大於處於臨床階段的免疫細胞治療藥物的總數。
圖3 2023年全球免疫細胞治療臨床試驗階段分佈
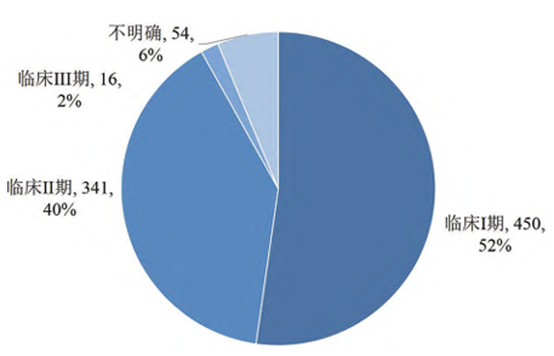
資料來源: Cortellis資料庫
細胞治療臨床研究轉化實現多項突破
多款突破性細胞治療藥物進入臨床階段。新加坡細胞治療企業BioSyngen全球首款鼻咽癌免疫細胞治療藥物獲得美國食品和藥品管理局(FDA) Ⅰ/Ⅱ期臨床試驗許可。上海細胞治療集團自主研發的全球首個自分泌納米抗體CAR-T細胞藥物正式獲批開展Ⅰ/Ⅱ期臨床試驗,用於治療間皮素陽性晚期實體腫瘤。北京基因啟明生物科技有限公司研發的“GKL-006注射液”作為我國首個針對肝癌的iNKT細胞(invariant natural killer T cell,恒定自然殺傷T細胞)治療產品,獲批進入臨床階段。細胞治療的臨床應用潛力進一步得到驗證。英國倫敦大學學院和大奧蒙德街兒童醫院開發了一種基於堿基編輯的通用現貨型CAR-T細胞,用於治療3名急性淋巴細胞白血病患者,其中2名患者治療後成功康復,這是全球首個基於堿基編輯的通用型細胞療法人體臨床試驗。Cell Reports Medicine發佈了中國首個獲批臨床試驗的TCR-T療法——TAEST16001的Ⅰ期臨床試驗結果,結果顯示,接受規定細胞劑量的12名患者中,9名 (75%) 患者顯示腫瘤消退,6名 (50%) 患者在第一次放射學評估後腫瘤負荷持續下降。為評估中國人群免疫細胞治療的療效和安全性,瑞金醫院血液科趙維蒞團隊基於阿基侖賽注射液開展了全國多中心非干預性臨床研究,結果發現阿基侖賽注射液可使“原發難治和12個月內復發”的大B細胞淋巴瘤患者獲益,CAR-T細胞治療作為一種全新的腫瘤治療手段在中國人群的資料得到國際認可。
細胞治療產業化進程
2023年,細胞治療的產業化持續加速,通用型免疫細胞產品、TCR-T、TIL等新型細胞治療藥物上市進程的加快推動市場向多元化與差異化發展,同時,政策與融資層面充分肯定了免疫細胞治療領域的重要性與高增長潛力,監管體系的完善保障了細胞治療藥物臨床應用的安全性和有效性持續提升。
從產品上市情況來看,2023年,全球共有6款免疫細胞治療藥物上市或處於上市申請階段,其中已上市3款,分別為全球首個獲批上市的現貨型同種異體免疫細胞療法Ebvallo、首個獲批上市的中國全自主智慧財產權CD19 CAR-T細胞治療產品納基奧侖賽注射液和全球首個獲批上市的全人源BCMA CAR-T細胞治療藥物伊基奧侖賽。
從已上市產品來看,Atara Biotherapeutics和Pierre Fabre的Ebvallo (Tabelecleucel)於2023年8月由歐盟委員會(EC)批准上市,是全球首個獲批上市的現貨型同種異體免疫細胞療法,以人類白細胞抗原(HLA) 限定的方式靶向受EBV感染的細胞,被作為單藥治療EB病毒相關的移植後淋巴增殖性疾病(EBV+PTLD)。合源生物的納基奧侖賽注射液(源瑞達)於2023年11月由我國國家藥品監督管理局(NMPA) 附條件批准上市,是首個獲批上市的具有中國全自主智慧財產權的CD19 CAR-T細胞治療產品,用於治療成人復發/難治性B細胞急性淋巴細胞白血病。馴鹿生物伊基奧侖賽注射液(福可蘇)於2023 年6月由國家藥品監督管理局批准上市,是全球首個獲批上市的全人源BCMA CAR-T細胞治療藥物,用於治療成人復發/難治性多發性骨髓瘤。
表2 2023年全球新上市的免疫細胞治療產品(截至2023年底)
| 藥物名稱 |
細胞類型 |
擁有企業 |
適應症 |
地區 |
| Ebvallo |
同種異體T細胞
治療藥物 |
AtaraBiotherapeutics、Pierre Fabre SA |
EB病毒相關的移植後淋巴增殖性疾病 |
歐盟 |
| 納基奧侖賽 |
CAR-T細胞治療藥物 |
合源生物科技(天津)有限公司 |
復發/難治性B細胞急性淋巴細胞白血病 |
中國 |
| 伊基奧侖賽 |
CAR-T細胞治療藥物 |
南京馴鹿生物醫藥有限公司 |
多發性骨髓瘤 |
中國 |
資料來源:《 2023年免疫細胞治療科技創新與產業發展態勢》
從即將上市的產品來看,Adaptimmune Therapeutics的Afami-cel 在 2022 年 12 月即遞交了上市申請,用於治療晚期滑膜肉瘤,有望成為全球首個獲批上市的TCR-T細胞治療藥物。Iovance Biotherapeutic的Lifileucel 於 2023 年 5 月向美國FDA遞交上市申請,用於治療晚期黑色素瘤,有望成為全球首款獲批上市的TIL細胞治療藥物。科濟藥業的澤沃基奧侖賽是一款全人源BCMA CAR-T細胞治療藥物,於2022年10月向國家藥品監督管理局遞交上市申請,用於治療復發/難治性多發性骨髓瘤。
細胞治療產業鏈
細胞治療產業鏈包括了上游的原材料供應商、中游的產品製造商以及下游的市場終端。
從產業鏈上游看,細胞存儲是目前整體市場中發展最為成熟且競爭最為激烈的細分產業,而儀器設備環節則受國內技術發展水準、海外廠商先發優勢等影響被進口廠商佔據較大市場份額,隨著國家圍繞國產替代,制定以及完善了系列支援性的利好產業政策,未來此領域將呈現出巨大發展潛力。
從產業鏈中游看,中國細胞治療臨床試驗占全球的半數以上,是全球較為活躍的細胞治療臨床研究地區之一。中國細胞治療產業的蓬勃發展,也對產業鏈的良性發展提出一定要求。例如在研發設計之初需要採取差異化戰略,選擇臨床需求未被滿足的適應症,制定最優的商業化策略;在研發生產過程中施行集約化、個體化生產,通過資訊技術等優化生產、降本增效,利於終端患者的藥物可負擔;針對生產企業本身,則需要保證產業鏈、供應鏈的穩定可控,加快國產替代進程。
從產業鏈下游看,目前相關藥物的適應症覆蓋有限,但因細胞治療藥物對腫瘤具有較強的靶向性識別和殺傷能力,可對腫瘤發起精准、高效地攻擊,受未滿患者需求、不斷發展的技術影響,相關應用場景也將進一步拓展延伸。
免疫細胞治療作為一種革命性的技術,在血液瘤等領域取得了多項突破性的進展,巨大的市場潛力吸引了資本的關注。即便是在資本寒冬之下,細胞治療賽道的融資熱度整體並未大幅下降,對TIL、TCR-T、CAR-NK等新型免疫細胞治療細分賽道的關注度有所上升。
從全球來看,據醫療市場研究出版商Kalorama Information 的資料,2023 年前三季度,全球細胞和基因治療領域共融資270億美元,主要集中在T細胞療法(CAR-T、TCR-T、TIL)、NK細胞療法等方向,致力於下一代CAR-T細胞療法的Cargo Therapeutics等公司在其中有突出表現。
從我國來看,2022年全年,行業投融資事件數量為508件,投融資金額超過667億元;2023年1—10月,行業投融資事件數量為322件,投融資金額超過421億元。據公開信息不完全統計,2023年免疫細胞領域全國共有近30家免疫細胞治療企業獲得融資,其中馴鹿生物、沙礫生物、來恩生物、恒瑞源正等企業融資金額靠前。
表3 2023年我國免疫細胞治療融資事件發生情況(截至2023年底)
| 融資時間 |
公司簡稱 |
涉及領域 |
輪次 |
金額 |
代表性投資機構 |
| 2023年1月 |
濟因生物 |
CAR-NK、CAR-T、CAR-M、
通用型細胞治療 |
天使輪 |
數千萬 |
深圳高新投;倚鋒資本;
合創資本;前海弘暉控股 |
| 2023年1月 |
貝斯生物 |
通用型Super-NK |
A1輪 |
數千萬美元 |
香港Great Eagle VC;
BV百度風投;信熹資本 |
| 2023年1月 |
馴鹿生物 |
CAR-T |
C輪 |
5億 |
國鑫投資;倚鋒資本;上海外高橋集團;南京江北國資;
厚新健投 |
| 2023年2月 |
河絡新圖 |
IPSC-CAR-iNK |
天使輪 |
數千萬 |
複容投資 |
| 2023年2月 |
灣島細胞 |
下一代免疫細胞治療 |
天使輪 |
近億 |
元生創投 |
| 2023年2月 |
原代細胞 |
CGT CDMO |
未透露 |
數千萬 |
複容投資 |
| 2023年2月 |
原啟生物 |
CAR-T |
B1輪 |
4500萬美元 |
RTW Investments;
Qatar Investment Authority;
啟明創投 |
| 2023年3月 |
新景智源 |
TCR-T |
A+輪 |
2億 |
元禾原點;遠毅資本;
格林美股份有限公司;
同高資本;中鑫資本 |
| 2023年4月 |
安諾柏德 |
CAR-T |
B輪 |
未透露 |
朗煜資本;博瑞醫藥 |
| 2023年4月 |
宜明細胞 |
CGT CDMO |
C+輪 |
1.5億 |
國泰君安創新投資;
濟南產發集團旗下經發基金與科金新動能基金;方富創投 |
| 2023年5月 |
藝妙神州 |
CAR-T |
E輪 |
數億 |
中國太平 |
| 2023年5月 |
先康達生命 |
CAR-T、
CAR-NK、
IPS-T |
Pre-A輪 |
數千萬 |
廣東聯景投資 |
| 2023年5月 |
恒瑞源正 |
TCR-T |
C輪 |
2億 |
紫金港資本;中科科創;
恒瑞醫藥 |
| 2023年6月 |
來恩生物 |
TCR-T |
B+輪 |
3億 |
廣州國聚投資;廣州產投;
石藥納德基金 |
| 2023年7月 |
恩瑞愷諾 |
CAR-NK |
Pre-A輪 |
數千萬 |
水木春錦資本;浙江複聚投資 |
| 2023年7月 |
藝妙神州 |
CAR-T |
E+輪 |
數億 |
清源德豐;國聯通寶資本;
聯峰資本 |
| 2023年7月 |
拜西歐斯 |
CIK、NK |
戰略投資 |
未透露 |
融昱資本;康悅資管 |
| 2023年8月 |
亙喜生物 |
CAR-T |
私募股權融資 |
1.5億
美元 |
Vivo Capital;
Adage Capital Partners LP;
Exome Asset Management;
Janus Henderson Investors |
| 2023年8月 |
艾凱生物 |
iPSC來源通用型細胞療法 |
A++輪 |
1億 |
知一投資;西湖科創投 |
| 2023年9月 |
沙礫生物 |
TIL |
B輪 |
4億 |
中金資本旗下基金;前海方舟;聯東投資;源禾資本 |
| 2023年9月 |
賽元生物 |
CAR-M |
iPSC來源的CAR-M |
數千萬 |
紫金港資本;余杭國投集團 |
| 2023年9月 |
啟函生物 |
iPSC來源免疫
細胞療法 |
Pre-B輪 |
超億 |
浙江省產業基金有限公司 |
| 2023年10月 |
諾未生物 |
T細胞產品 |
Pre-B輪 |
5000萬 |
新投集團;聚焦基金 |
| 2023年10月 |
鑌鐵生物 |
TCR-T |
A輪 |
超億 |
國投創業;黃埔醫藥基金;
元希海河基金 |
| 2023年11月 |
拜西歐斯 |
CIK、NK |
B+輪 |
數千萬 |
松禾資本;聖諾生物;賽升藥業;廈門高新投 |
| 2023年11月 |
恒賽生物 |
DC |
A輪 |
數億 |
富匯創投;勤智資本;凱騎康盈 |
| 2023年11月 |
臻知醫學 |
CTL |
Pre-A+輪 |
數千萬 |
順禧基金;君實生物;雅惠投資 |
資料來源:前瞻產業研究院、醫麥克
參考文獻
[1]崔立勇.生物醫藥:國際競爭不可避免,合作不可或缺[N].中國經濟導報,2024-02-22(003).
[2]施明,謝雲波,王福生.腫瘤免疫細胞治療:前景與挑戰[J].中國腫瘤生物治療雜誌,2024,31(01):1-9.
[3]範月蕾,李榮,魯嵐等.2023年免疫細胞治療科技創新與產業發展態勢[J].生命科學,2024,36(01):102-110.
[4]Garry D,Cristina R,Aaron W, et al.Targeting of multiple tumor-associated antigens by individual T cell receptors during successful cancer immunotherapy. [J].Cell,2023,186(16):3333-3349.
[5]Yan P,Wenqing Z,Yufeng C,et al.Engineering c-Met-CAR NK-92 cells as a promising therapeutic candidate for lung adenocarcinoma[J].Pharmacological Research,2023,188106656-106656.
[6]Gabriel C,Andrea C,Adele M,et al.Epitope editing enables targeted immunotherapyof acute myeloid leukaemia.[J].Nature,2023,621(7978):404-414.
[7]Robert C ,Christos G ,Farhatullah S , et al. Base-Edited CAR7 T Cells for Relapsed T-Cell Acute Lymphoblastic Leukemia.[J].The New England journal of medicine, 2023,389(10).
[8]曹涵博,張強,王莉芳等.我國幹細胞製劑的監管現狀與進展[J].中國藥業,2024,33(03):26-30.
[9]藥明康得內容團隊.2023年中國創新藥領域發展五大看點[N].中國醫藥報,2024-01-18(005).