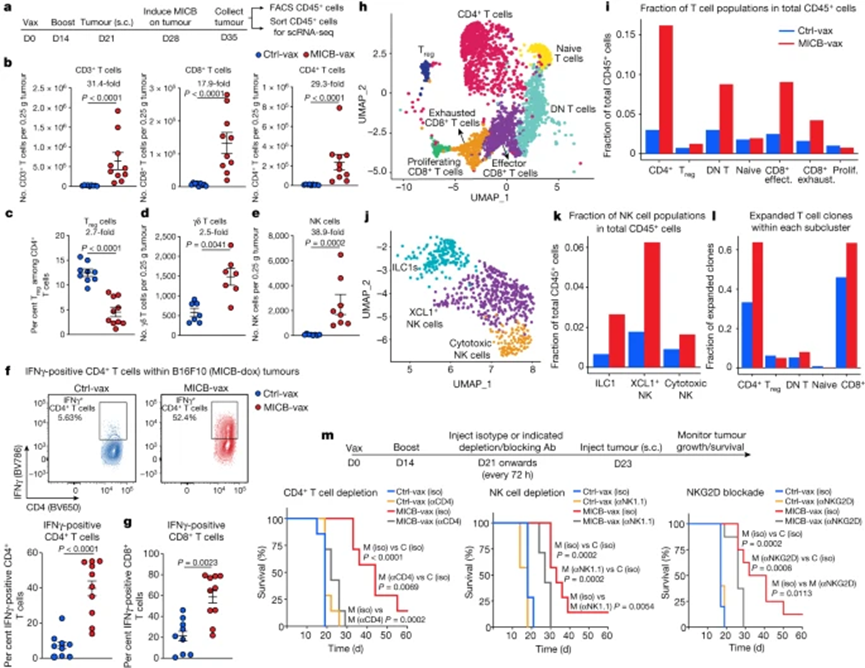
免疫學:新型殺傷性抗癌免疫細胞!
說起抗腫瘤免疫反應,我們最先想到的就是細胞毒性T細胞的腫瘤殺傷功能。作為一種適應性免疫細胞,T細胞的殺傷功能依賴於對腫瘤抗原的識別,然而,許多腫瘤類型缺乏免疫原性抗原[1]。
在這種情況下,天然淋巴細胞(ILCs)的腫瘤免疫監視功能就凸顯出來了,其中最為熟知的當屬自然殺傷(NK)細胞[2]。除了NK細胞外,其他ILCs的功能也越來越受到關注,不過在之前的研究中,大家更多的認為ILCs主要發揮類似於CD4+T細胞的輔助作用,最近的一些研究發現,ILC1可能也具有細胞毒性功能,能直接殺傷靶細胞。近日,來自美國紀念斯隆–凱特林癌症中心的李明團隊,在《自然・免疫學》期刊發表重要研究成果。
他們發現ILC1可以感知腫瘤細胞分泌的IL-15,從而發揮細胞毒性作用,直接殺傷腫瘤細胞[3]。這一發現拓展了我們對天然淋巴細胞功能的認知,並可能為一些腫瘤的治療帶來新的思路。
腎細胞癌是男性和女性最常見的十大癌症之一,其組織學上不同的亞型表現出不同的治療反應[4]。雖然免疫檢查點抑制劑大大提高了腎透明細胞癌(ccRCC)患者的生存期,但腎嫌色細胞癌(chRCC)患者通常對治療反應不佳[5]。那麼,是什麼原因導致了這一差異呢?
為了研究導致差異結果的免疫學基礎,李明團隊對從ccRCC和chRCC晚期患者腫瘤中分離的免疫細胞進行了單細胞RNA測序分析。結果發現,這兩種癌症亞型浸潤的免疫細胞群果然有著較大差異。他們發現,ccRCC中浸潤的主要是CD8+T細胞,而chRCC中存在兩種具有細胞毒性的先天淋巴細胞,其中一種具有典型NK細胞特徵,另一種具有ILC1細胞的特性。單細胞測序資料表明,ccRCC中有大量CD8+T細胞浸潤,但chRCC中浸潤的ILC1s相對更多,對大量的腎細胞癌腫瘤樣本、癌旁正常組織以及患者的血液樣本進行流式分析,來驗證前面的發現。他們發現,與癌旁正常組織和血液相比,ccRCC腫瘤中CD8+T細胞明顯更多,在chRCC組織中則沒有顯著差異。與之相反的是,在chRCC中ILC1細胞顯著增加。有趣的是,ILC1標記基因的高表達與chRCC患者較好的總生存率相關,但卻和ccRCC患者較差的總生存率相關,這一相反的結果提示,ILC1在不同腫瘤中的功能可能存在差異。
TCGA資料庫分析顯示,ILC1標記基因的高表達與ccRCC的不良預後相關,但在chRCC中情況相反,是什麼因素使得ILC1在chRCC和ccRCC中有著不同作用呢?研究人員分析單細胞轉錄組資料發現,儘管在chRCC和ccRCC腫瘤中都有ILC1浸潤,但它們表現出不同的顆粒酶A表達模式。之前的研究已經發現,顆粒酶A可以介導靶細胞發生凋亡或焦亡[6,7]。
對chRCC和ccRCC腫瘤中顆粒酶A的蛋白表達進行檢測可以發現,在同一chRCC腫瘤樣本中,ILC1始終比NK細胞表達更多顆粒酶A,但ccRCC中則有著相反的結果。此外,來自chRCC腫瘤組織的ILC1比來自癌旁正常組織的ILC1表達更高水準的顆粒酶A。那麼,是什麼原因導致了ILC1表現出不同的特徵呢?先前的研究表明,細胞因數IL-15和其受體α鏈(IL-15Rα)形成的複合物,可促進細胞毒性淋巴細胞的發育和效應功能[8]。TCGA資料庫分析發現,chRCC腫瘤比ccRCC腫瘤表達更高水準的IL15,這意味著腫瘤微環境中的IL-15水準可能以劑量依賴的方式調節ILC1的反應。因此,研究人員進一步探究了IL-15對ILC1的調控作用。
研究人員從RCC腫瘤中分離了ILC1,並將它們分別用兩種不同劑量的IL-15/IL-15Rα複合物培養。結果發現,高劑量的IL-15/IL-15Rα複合物可以誘導ILC1表達更高水準的顆粒酶A。此外,高劑量的IL-15/IL-15Rα大大增強了ILC1對靶細胞的殺傷作用。高劑量的IL-15/IL-15Rα複合物增強了ILC1s對靶細胞的殺傷作用。紅色箭頭表示ILC1,白色箭頭表示死亡的靶細胞(K562)
值得一提的是,在TCGA資料庫的chRCC患者樣本中,IL-15表達水準和ILC1標記基因的富集程度呈正相關。此外,IL-15高表達的患者比低表達的患者有更好的總生存期。這些發現表明IL-15可以增強腫瘤中ILC1對靶細胞的殺傷能力,這可能是控制chRCC患者腫瘤的一個關鍵機制。團隊對這一發現進行了拓展在其他上皮性惡性腫瘤中,IL-15是否也可以調控ILC1介導的抗腫瘤免疫反應?乳腺癌是世界上最常見的癌症之一,研究人員發現,在PIK3CA突變的乳腺癌患者中,ILC1的標記基因與更好的生存率相關,並且ILC1標記基因與IL15表達呈正相關。這些結果提示,IL-15調控的ILC1在PIK3CA突變的乳腺癌中也可能具有重要功能。
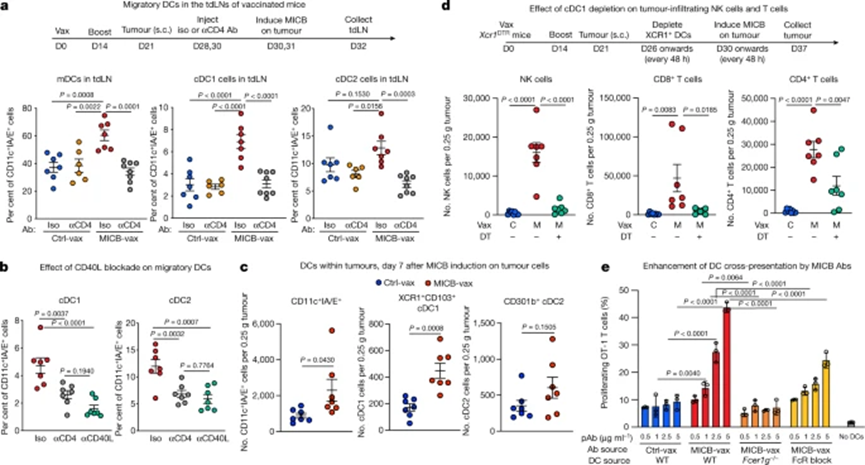
在PIK3CA突變的乳腺癌患者中,ILC1的標記基因與更好的生存率相關,且ILC1標記基因與IL15表達呈正相關,團隊利用PyMT驅動的乳腺癌轉基因小鼠模型(類比PIK3CA突變的乳腺癌),來進一步破譯腫瘤微環境中IL-15對ILC1的調控機制。首先需要回答的一個問題是,什麼細胞分泌的IL-15影響了ILC1的功能?團隊利用IL-15報告基因小鼠發現,腫瘤中的巨噬細胞和樹突狀細胞高表達IL-15,然而奇怪的是,在條件性敲除巨噬細胞和樹突狀細胞中的IL15基因後,腫瘤中浸潤的ILC1比例和功能並沒有受到影響。類似的,李明團隊還發現血液細胞和基質細胞來源的IL-15也不影響這一過程。
既然這些細胞似乎都不影響ILC1,那麼是否有可能是腫瘤細胞直接調控了ILC1的反應呢?研究人員通過螢光成像發現,ILC1似乎可以與腫瘤細胞相互作用,並直接感知腫瘤細胞,那麼腫瘤細胞本身是否可能分泌IL-15驅動ILC1的抗腫瘤免疫反應呢?研究人員在條件性敲除腫瘤細胞中的IL-15基因後發現,腫瘤中浸潤的ILC1的數量顯著降低,且剩下的ILC1的效應功能也下降了。這些結果表明,腫瘤細胞來源的IL-15調節細胞毒性ILC1的擴增和效應功能,而缺乏這些效應細胞會導致腫瘤免疫反應受損。IL-15在PyMT腫瘤細胞中高表達,敲除腫瘤細胞的IL15後,腫瘤中ILC1的比例顯著降低,這項研究揭示了一種先天淋巴細胞對腫瘤的免疫監測機制,通過該機制,腫瘤細胞表達的IL-15可以作為警報素,被組織駐留的細胞毒性ILC1感知,這些發現可能為一些癌症的免疫治療打開新的思路。表達顆粒酶C的ILC細胞來自ILC祖細胞,且不與NK細胞、ILC2或ILC3相互轉化。在功能上,這群細胞在抗腫瘤免疫和自身免疫反應中都有著重要作用[9]。
這些發現都將拓展我們對ILC細胞的認知,並為腫瘤免疫治療帶來新的見解。
參考文獻
1.T. N. Schumacher, R. D. Schreiber, Neoantigens in cancer immunotherapy. Science 348, 69-74 (2015).
2.L. Chiossone, P. Y. Dumas, M. Vienne, E. Vivier, Natural killer cells and other innate lymphoid cells in cancer. Nat Rev Immunol 18, 671-688 (2018).
3.E. R. Kansler et al., Cytotoxic innate lymphoid cells sense cancer cell-expressed interleukin-15 to suppress human and murine malignancies. Nat Immunol 23, 904-915 (2022).
4.C. M. Diaz-Montero, B. I. Rini, J. H. Finke, The immunology of renal cell carcinoma. Nat Rev Nephrol 16, 721-735 (2020).
5.B. A. McGregor et al., Results of a Multicenter Phase II Study of Atezolizumab and Bevacizumab for Patients With Metastatic Renal Cell Carcinoma With Variant Histology and/or Sarcomatoid Features. J Clin Oncol 38, 63-70 (2020).
6.Z. W. Zhou et al., Granzyme A from cytotoxic lymphocytes cleaves GSDMB to trigger pyroptosis in target cells. Science 368, 965-+ (2020).
7.J. Lieberman, Granzyme A activates another way to die. Immunol Rev 235, 93-104 (2010).
8.P. F. Fiore et al., Interleukin-15 and cancer: some solved and many unsolved questions. Journal for Immunotherapy of Cancer 8, (2020).
9.B. G. Nixon et al., Cytotoxic granzyme C-expressing ILC1s contribute to antitumor immunity and neonatal autoimmunity. Sci Immunol 7, eabi8642 (2022).