2025年12月24日 11:28 吉林



2025年12月24日 11:28 吉林






一、傷口癒合的“攔路虎”
正常傷口癒合分4個階段:
止血期:血管收縮,血小板形成血凝塊封堵傷口;
炎症期:免疫細胞清除病原體與壞死組織,啟動修復;
增殖期:各類細胞活化,促進血管生成與上皮再生;
重塑期:膠原纖維重排,形成成熟疤痕。
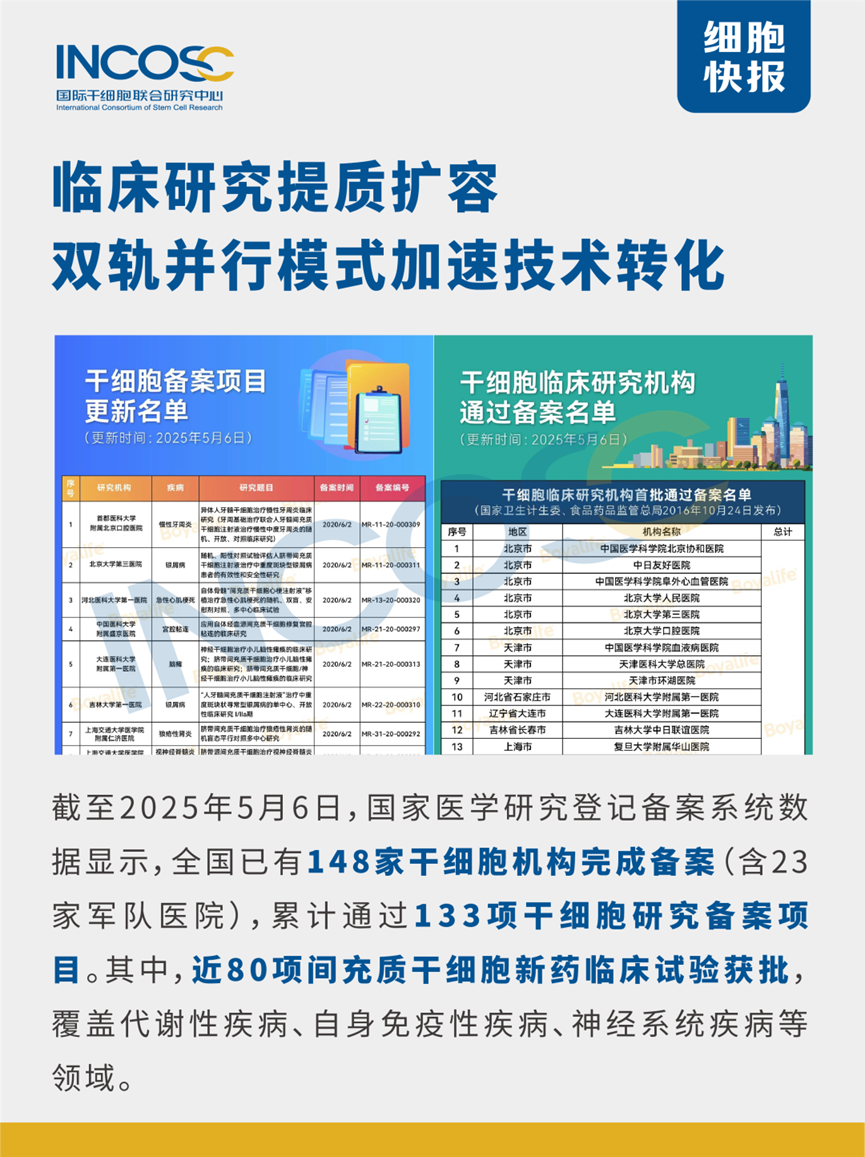
流程“卡殼”會導致兩類問題:一是慢性傷口,即3個月未愈的潰瘍,如糖尿病潰瘍(高血糖引發氧化應激)、壓力性潰瘍(骨突受壓致壞死),核心特徵是“炎症不消、再生無力”;二是病理性疤痕,由成纖維細胞異常增殖導致,與免疫失調、機械張力、缺氧相關。
遺憾的是,現有治療存在瓶頸:細胞治療有免疫排斥與倫理爭議;天然藥物靶向性差、易降解。而外泌體的出現,恰好填補了空白。
二、外泌體:從“細胞信使”到治療“潛力股”
外泌體是細胞分泌的30-150nm脂質囊泡,包裹蛋白質、mRNA等活性物質,相當於細胞間的“納米快遞”。與其他療法相比,天然外泌體有三大優勢:
安全性高:無免疫原性、致瘤性,規避幹細胞治療風險;
穩定性強:脂質膜保護內容物不被降解,更耐儲存;
靶向性初顯:表面蛋白可初步識別靶組織。
其作用機制有三種:“表面對接”啟動信號、“內部投遞”釋放內容物、“直接融合”傳遞物質。但天然外泌體存在靶向性差、有效成分少、產量低等問題。為此,科學家開發了工程化外泌體(eExo),通過改造實現按需定制,增強靶向性與“4種促進”、“5種抵抗”效應。
“4種促進”效應是工程化外泌體促進傷口再生的核心能力,包含:
促血管生成:通過攜帶VEGF(血管內皮生長因數)相關miRNA(如miR-31-5p),啟動內皮細胞增殖與遷移,在慢性傷口缺氧區域形成新血管,為修復提供氧氣與營養;促細胞增殖:調控成纖維細胞、角質形成細胞活性,加速肉芽組織生長與上皮細胞覆蓋,縮短傷口閉合時間,尤其對糖尿病患者因高糖抑制的細胞增殖有顯著恢復作用;促ECM(細胞外基質)沉積:引導成纖維細胞合成膠原蛋白、彈性蛋白等ECM成分,並減少異常沉積,避免疤痕過度形成;促神經再生:攜帶神經營養因數相關信號分子,修復傷口區域受損神經末梢,緩解慢性傷口伴隨的疼痛、麻木,同時改善皮膚感知功能。
“5種抵抗”效應則為傷口癒合掃清障礙,包含:
抗炎:抑制NF-κB等炎症通路,減少TNF-α、IL-6等促炎因數釋放,將慢性傷口的“持續炎症”轉為“可控炎症”,為修復階段鋪路;抗纖維化:下調TGF-β1等促纖維化因數,抑制成纖維細胞過度活化,防止膠原蛋白無序堆積,減少增生性疤痕形成;抗凋亡:通過啟動PI3K/AKT通路,保護傷口區域的上皮細胞、內皮細胞免受氧化應激損傷,降低細胞凋亡率,維持修復細胞數量;抗衰:清除傷口局部衰老細胞(如衰老成纖維細胞),減少衰老相關分泌表型(SASP)對修復的干擾,恢復細胞修復活力;抗氧化:攜帶SOD(超氧化物歧化酶)、谷胱甘肽等抗氧化物質,中和慢性傷口中過量的活性氧(ROS),打破“氧化應激-細胞損傷”的惡性循環。
三、從實驗室到臨床的進展與挑戰
臨床前研究:動物模型顯效
96.6%研究集中在齧齒類動物。糖尿病小鼠模型中,iPSC來源外泌體減少炎症、縮小傷口;兔耳疤痕模型中,載miR-141-3p外泌體減少疤痕厚度[1]。但小鼠皮膚與人類差異大,需大動物模型進一步驗證。
臨床研究:初現安全與有效
截至2025年,多項臨床研究啟動。韓國一項前瞻性、雙盲、隨機、半臉對照研究中,“脂肪幹細胞外泌體+鐳射”改善痤瘡疤痕,紅腫輕恢復快;美國IIa期研究(NCT06319287)評估外泌體產品治糖尿病足潰瘍效果;中國也有多項研究開展,例如半臉對照研究(NCT06279039)評估含外泌體的液體敷料對鐳射治療後患者康復的影響,人脂肪組織來源外泌體促進傷口癒合的初步研究(NCT05475418)。但需大規模研究驗證長期療效。
| 研究編號/PMID | 疾病/症狀 | 治療 | 研究階段 | 研究指標 |
| NCT04134676 | 慢性潰瘍 | 條件培養基 | Phase 1 | 2周時潰瘍大小、肉芽組織、水腫和紅斑 |
| ACTRN12620000944932 | 傷口 | 血小板衍生EV | Phase 1 | 不良事件和傷口癒合時間 |
| NCT02565264 | 潰瘍 | 血漿來源的外泌體 | Phase 1 | 28天時潰瘍大小和疼痛 |
| 33073298 | 痤瘡疤痕 | ASC衍生外泌體 | Phase 1 | 3周時瘢痕改善和副作用的評價 |
| NCT04326959 | 疤痕 | UCSC-CM | Phase 1 & 2 | 3個月時瘢痕疙瘩的免疫組織化學、組織病理學和影像學 |
| NCT06319287 | 糖尿病足潰瘍 | PEP/TISSEEL | Phase 2 | 12周時傷口面積減少百分比 |
| NCT05887804 | 疤痕 | UCSC-CM | Phase 4 | 15周時瘢痕疙瘩體積減少,17周時POSAS評分降低 |
| NCT06253975 | 傷口癒合 | AT-EV | n/a | 10周時傷口癒合率 |
| NCT05475418 | 創傷和損傷 | AT-exo | n/a | 4周時傷口癒合率 |
ASC,脂肪源性幹細胞;EV,細胞外囊泡;AT-exo,脂肪組織來源的外泌體;UCS-CM,臍帶間充質幹細胞衍生條件培養基;PEP,純化的外泌體產物;POSAS,患者和觀察者瘢痕評估量表
核心挑戰:規模化、安全與監管
規模化生產難:實驗室產量低,臨床需標準化流程保證批次品質;
免疫原性風險:異體外泌體或引發反應,自體外泌體成本高、週期長;
監管缺失:全球無統一指南,延緩轉化。
結語:未來展望
工程化外泌體兼具生物相容性與精准治療能力,未來研究將聚焦三方面:優化改造技術,提升cargo載入效率;改進遞送系統,延長體內滯留時間;明確作用機制,找到關鍵療效分子。從“納米碎片”到“治療工具”,外泌體發展僅數十年。隨著技術與監管完善,未來它或將走進臨床,讓慢性傷口不再“難愈”,疤痕不再“難纏”。
參考資料
1.Kwon, Hyuck Hoon, et al. “Combination treatment with human adipose tissue stem cell-derived exosomes and fractional CO2 laser for acne scars: a 12-week prospective, double-blind, randomized, split-face study.” Acta dermato-venereologica 100.18 (2020): 5913.
2.Liu, Chuanqi, et al. “Precision exosome engineering for enhanced wound healing and scar revision.” Journal of Translational Medicine 23.1 (2025): 578.
3.Dandoulakis, MD, E. . “Exosomes As A Revolutionary Tool In Wound Healing And Skin Regeneration: Current Evidence And Therapeutic Potential”. Journal of Neonatal Surgery, vol. 14, no. 32S, July 2025, pp. 5817-29
呈現出以下情況:
產業鏈
上游:幹細胞採集與存儲業務成熟,主要存儲間充質與造血幹細胞,經營模式有公共庫及自體庫。代表企業有中國臍帶血庫企業集團、中源協和等。
中游:幹細胞增殖與藥物研發企業以輸出幹細胞治療技術為主,針對神經系統疾病、糖尿病等疑難疾病提供技術。2025年1月1日至3月22日,有7款幹細胞藥物被CFDA正式受理,但尚無獲准上市的幹細胞藥物產品。
下游:由開展幹細胞醫療的機構組成,以三甲醫院為主,用於組織細胞損傷修復、器官移植等疾病治療及醫學美容。代表醫院有解放軍302醫院、武警總醫院幹細胞移植治療中心等。
市場規模
我國幹細胞產業市場規模呈逐年增長趨勢,2010年為30億元,2023年達880.4億元,2024年突破1000億元,預計2029年將超過2000億元。
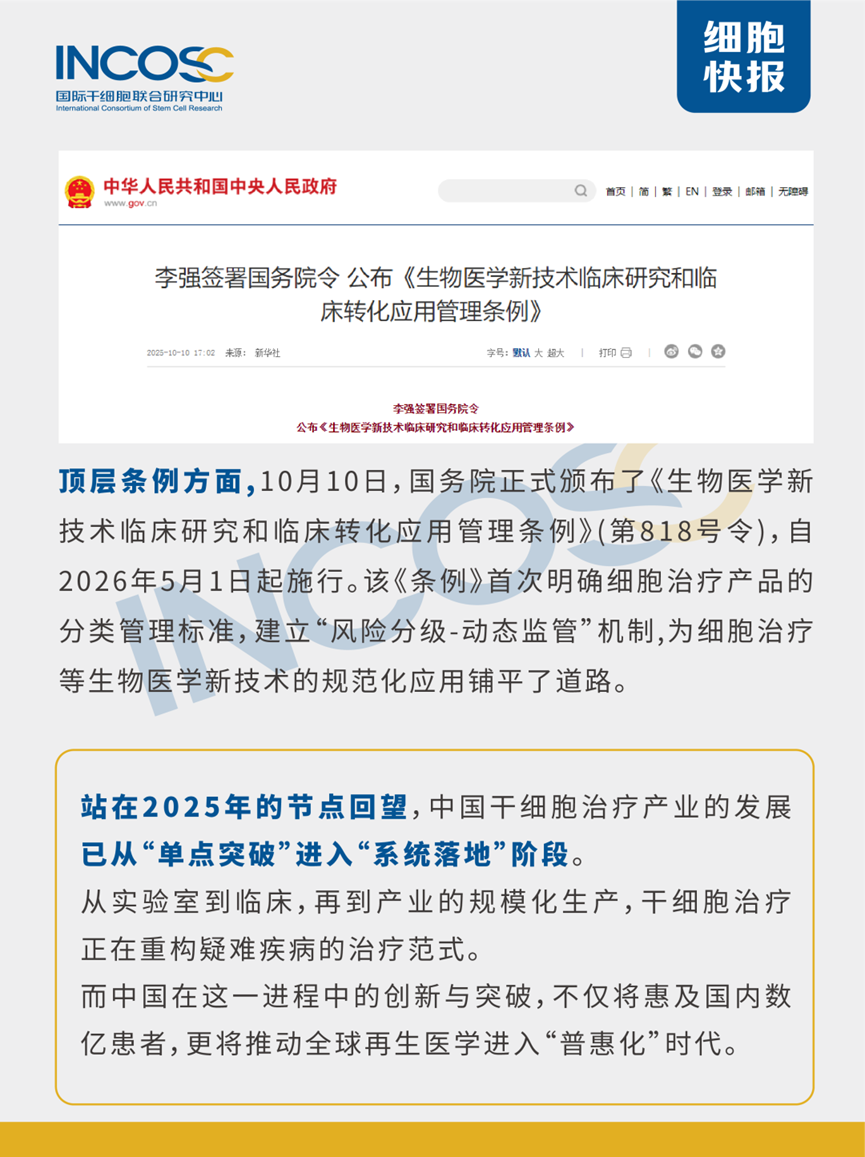
政策支持
2024年允許外商投資幹細胞藥物研發和應用,2025年“幹細胞研究與器官修復”被列為國家重點研發計畫重點專項,政策扶持推動產業發展。
技術研究
從基礎研究來看,中國發表論文和專利的數量在國際上僅次於美國,但在轉化應用方面,進入臨床研究的項目占比不高,尤其是進入二期、三期臨床的比例更低。
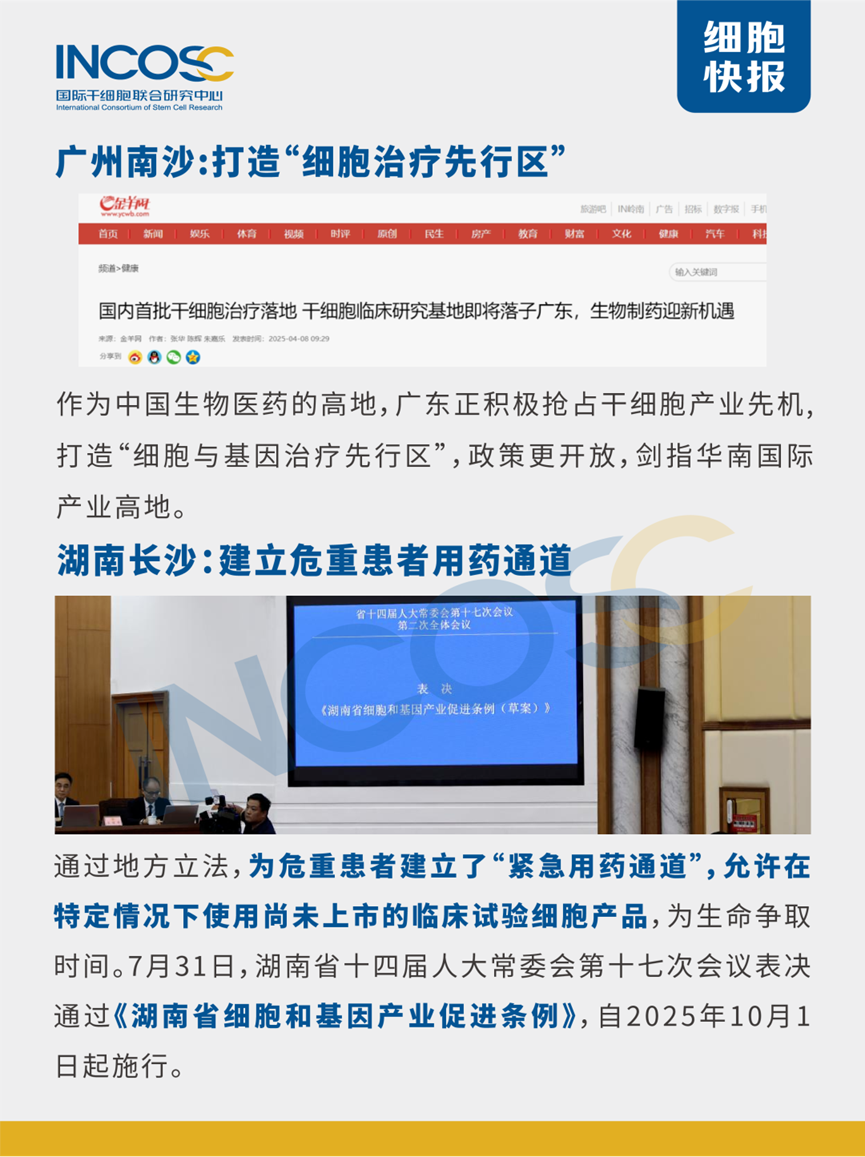
區域發展
廣州致力於打造從實驗室到病床的完整鏈條,南沙國際精准醫療中心正在建設中;海南博鼇樂城國際醫療旅遊先行區允許幹細胞技術臨床收費應用,首批3個幹細胞技術專案已落地。
企業格局
企業分三個梯隊,第一梯隊的中源協和等老牌細胞存儲機構有先發優勢;第二梯隊的四川新生命幹細胞等企業有區域業務優勢;第三梯隊為小型、新進入或跨界轉型企業,業務單一,品質參差不齊。
最大規模單細胞擾動測序資料集,AI支持虛擬細胞研究
2024 年 4 月,一家名為 Xaira Therapeutics 的人工智慧(AI)藥物研發公司成立,並同時宣佈獲得了令人瞠目結舌的 10 億美元種子輪融資。該公司致力於通過新興 AI 技術的端到端應用,幫助重新設計藥物的發現和開發之旅。
該公司擁有一個星光熠熠的創始和領導團隊,包括 AI 蛋白質設計先驅、2024 年諾貝爾化學獎得主 David Baker 教授,以及 2022 年諾貝爾化學獎得主 Carolyn Bertozzi 教授、美國 FDA 前局長 Scott Gottlieb、強生公司前 CEO Alex Gorsky,以及斯坦福大學前校長 Marc Tessier-Lavigne 等。因此,整個 AI 藥物研發領域都在熱切期待著該公司取得令人矚目的科學成果。
現在,這家 AI 獨角獸企業不負眾望,在其成立的第一年就為虛擬細胞(Virtual Cell)研究領域送上了一份厚禮——發佈了目前最大的公開可用的 Perturb-seq 資料集,名為 X-Atlas/Orion,為虛擬細胞研究提供支援,該資料集可用於 AI 模型訓練,並能檢測劑量依賴性遺傳效應,從而增強藥物發現的預測能力。
該資料集於 2025 年 6 月 16 日發表在預印本平臺 bioRxiv,論文題為:X-Atlas/Orion: Genome-wide Perturb-seq Datasets via a Scalable Fix-Cryopreserve Platform for Training Dose-Dependent Biological Foundation Models。
根據論文中的介紹,X-Atlas/Orion 包含了 8000000 個細胞,涵蓋了人類所有編碼蛋白質的基因,單細胞的深度測序超過 16000 個獨特分子識別字(UMI)。
Perturb-seq 是基於單細胞轉錄組測序(scRNA-seq)、以彙集的形式同時讀出單細胞的 CRISPR sgRNA 遺傳擾動和轉錄組的方法。過去,研究人員一直將 Perturb-seq 基因敲低視為一種“開”或“關”的開關,而 X-Atlas/Orion 通過檢測劑量依賴性遺傳效應取得了進步,從而揭示了基因活性如何隨著特定干預措施的強度而變化,例如,可應用於確定對藥物靶點的抑制百分比達到多少時會產生預期治療效果。

大規模平行測序技術的迅猛發展催生了基礎模型開發生態,這類模型可通過解析海量生物資料揭示全新生物學發現。然而,儘管 AI 驅動的虛擬細胞模型具備加速科學發現的革命性潛力,其發展始終受限於高品質擾動資料的規模性短缺——這一困境源于資料生成過程的可擴展性瓶頸與實驗方法變異性的雙重制約。
該研究推出了創新性的“固定–凍存–單細胞測序”(Fix-Cryopreserve-scRNAseq, FiCS)Perturb-seq 平臺,該工業化解決方案實現了擾動測序數據的規模生產。
實驗驗證表明,FiCS 平臺展現出卓越的檢測靈敏度與微弱的批次效應,能精准捕捉基因擾動引發的轉錄組變化,準確重現經典生物學通路與蛋白複合體特徵。作為技術示範,Xaira Therapeutics 正式發佈當前全球最大規模的公共擾動資料庫——X-Atlas/Orion。該資料集源自兩項針對人類全部蛋白質編碼基因的全基因組 FiCS Perturb-seq 實驗,包含 8000000 個深度測序細胞,單細胞獨特分子識別字(UMI)超 16000 個,為領域研究樹立新標杆。
該研究還揭示,sgRNA 豐度可作為基因敲低效能的有效表徵。通過深度測序與每次擾動條件下充足細胞量的技術優勢,證實基於 sgRNA 表達的劑量分層可解析遺傳效應的濃度依賴性特徵。
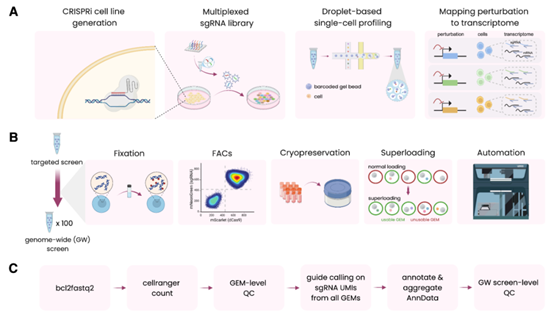
工業化 Perturb-seq 平臺工作流
綜合來看,FiCS Perturb-seq 成功打造了高效、可擴展的高通量擾動測序平臺。通過 X-Atlas/Orion 資料集的發佈,不僅為解決資料生成中的規模化和標準化難題提供關鍵方案,更將推動融合基因劑量效應的新一代基礎模型開發,為加速生命科學發現注入強勁動力。
為促進虛擬細胞研究領域的開放協作,X-Atlas/Orion 資料集將以非商業使用許可向生物技術界開放共用。對於有意開展商業合作的公司,Xaira Therapeutics 表示願意就資料授權與應用開發等合作模式進行商談。
對於傳統的早期藥物研發,通常僅限於從文獻中挑選少數幾個基因進行嘗試,但高性能的虛擬細胞(Virtual Cell)模型卻有可能在研發流程中不良生物學效應出現之前就將其排除。
許多虛擬細胞模型是基於觀察資料訓練的,例如 CZ CELLxGENE,其單細胞資料主要來自健康的人類捐贈者,雖然觀察資料對於某些生物學研究任務(例如細胞類型注釋)非常有用,但在預測細胞對擾動(例如藥物治療)的回應方面卻存在不足。
在 Perturb-seq 中,由於單細胞資料集的隨機性和稀疏性,測量基因敲低效率一直頗具挑戰性。為解決這一難題,Xaira Therapeutics 的研究人員證明,sgRNA 的豐度在每個細胞中能被檢測到並表達數百個拷貝,這在單細胞檢測中極為罕見,並且為基因被抑制的程度提供了一個可靠的替代指標。
除了 Xaira Therapeutics,還有多個機構致力於構建虛擬細胞,例如,陳-紮克伯格倡議(CZI)在今年 4 月份發佈了 Transcript Former,這是一種生成式 AI 模型,能夠跨物種探究細胞生物學,並具有治療應用。與此同時,Arc 研究所宣佈與 10x Genomics 和 Ultima Genomics 建立合作夥伴關係,共同構建 Arc 虛擬細胞圖譜。
像 X-Atlas/Orion 這樣大規模全基因組實驗可能極其耗時。僅對細胞進行分類以富集高品質細胞就可能需要超過 10 個小時。通過發佈 X-Atlas/Orion 的方法,Xaira Therapeutics 旨在讓更多的實驗室能夠以大規模、高品質和標準化的規模生成 Perturb-seq 資料,讓各個實驗室有能力利用大規模資料來檢驗特定假設。
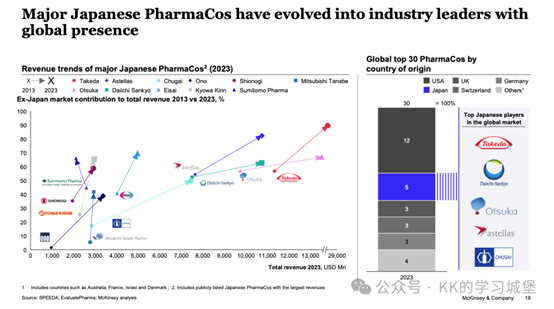
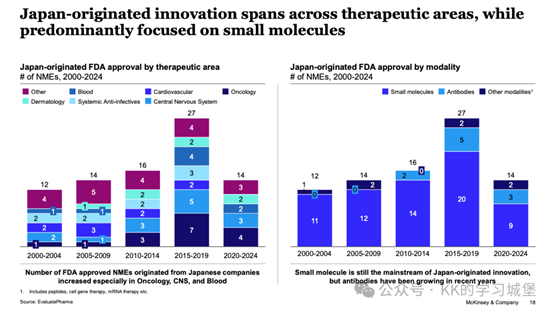
日本擁有全球Top 30藥企中的5席(武田、第一三共、安斯泰來、中外製藥、大塚製藥),海外收入占比從2013年平均30%躍升至2023年的超50%。過去20年,日本企業貢獻了27款FDA批准的重磅新藥(如Enhertu、Opdivo),成為亞洲生物醫藥創新的核心引擎。
一、全球化歷程:三大戰略階段
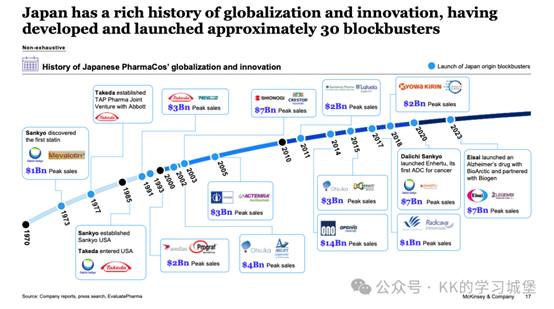
– 武田×雅培成立合資公司TAP Pharma,推出前列腺癌藥Lupron(峰值銷售額$10億)
– 第一三共發現全球首個他汀類藥物美伐他汀(Mevalotin®)
– 鹽野義將降脂藥Crestor授權給阿斯利康(峰值$70億)
– 第一三共×阿斯利康合作開發ADC藥物Enhertu(2024年銷售額$25億)
– 小野製藥×百時美施貴寶推出PD-1抑制劑Opdivo(峰值$80億)
– 衛材×渤健共同開發阿爾茨海默病藥物Leqembi(2024年獲批)
– 武田以$620億收購夏爾(Shire),躋身全球十大藥企
– 安斯泰來建立全球腫瘤事業部,海外研發人員占比達40%
– 中外製藥依託羅氏網路實現80%收入來自海外
> 關鍵資料:日本藥企海外收入占比(2023) :– 武田:89% – 安斯泰來:68% – 第一三共:52% – 衛材:48%
> 創新管線佈局:從小分子到前沿療法
二、全球化四大模式解析
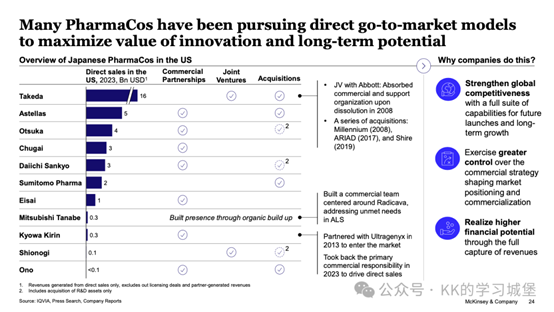
日本企業通過靈活組合策略打通全球市場,四種模式:授權合作、戰略聯盟、直接經營、股權融合。
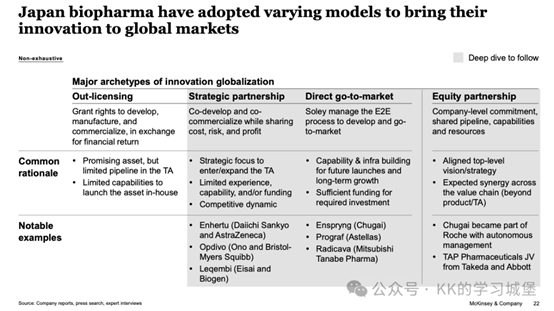
選擇自身直接經營,一般是考慮到:1)加強自身公司在全球競爭力,2)在商業化策略有更多掌握權,3)自身出海行銷能夠帶來更多回報。
戰略聯盟合作成功要素:

股權融合往往需要更多企業層面對於長期合作願景的一致,對於產品管線的研發在技術、人才方面作整合;對比前三種方式是更深入合作。

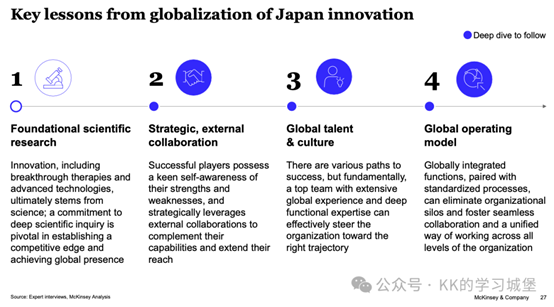
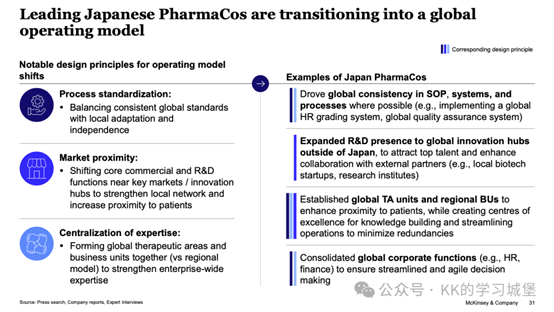
三、對亞洲製藥企業的啟示
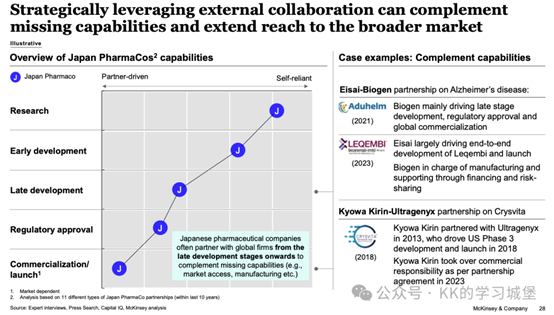
日本製藥公司經常從發展後期階段開始與全球公司合作,以彌補缺失的能力(例如市場准入、製造等)。
3. 高管團隊國際化、人才培育雙軌制
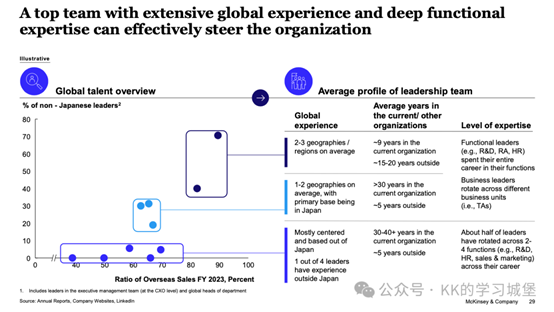
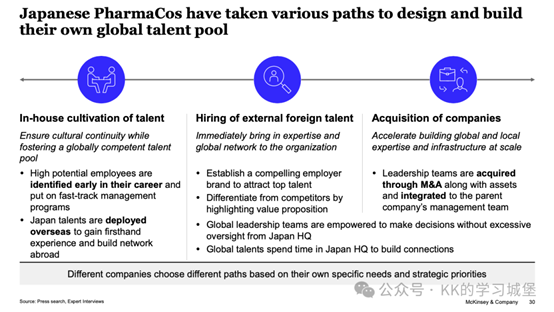
三個原則:
-流程標準化,平衡一致的全球標準與地方適應和獨立性。
-將核心商業和研發職能轉移到關鍵市場/創新中心附近,以加強本地網路並增加與患者的距離。
-共同形成全球治療領域和業務部門,以加強全企業的專業知識。
資料來源:McKinsey & Company《Asia Biopharma: Changing Markets, Changing Opportunities》(March 2025)
今日分享一則胎盤間充質幹細胞治療膝骨關節炎相關的臨床文獻。這項臨床試驗的原材料是冷凍保存的人胎盤間充質幹細胞,共納入26名II-III期膝骨關節炎患者。結果顯示,三次關節內注射低溫保存的胎盤間充質幹細胞聯合透明質酸治療膝骨關節炎是安全有效的,患者關節疼痛、僵硬及功能障礙得到顯著改善,並在1年隨訪中提供持續的臨床改善。
在醫學領域,膝骨關節炎(Knee Osteoarthritis, KOA)作為一種常見的退行性關節疾病,長期困擾著數以億計的患者。
隨著人口老齡化的加劇和肥胖率的上升,KOA的發病率逐年攀升,傳統治療方法如藥物治療、物理治療及手術治療雖能在一定程度上緩解症狀,但往往難以根治,且存在副作用大、療效有限等問題。
近年來,幹細胞療法作為一種新興的治療手段,為KOA患者帶來了新的希望。

最近,發表在“ BMC Musculoskeletal Disorders”上的一篇名為“Effectiveness and safety of multiple injections of human placenta-derived MSCs for knee osteoarthritis: a nonrandomized phase I trial”的臨床試驗表明,三次關節內注射低溫保存的胎盤間充質幹細胞聯合透明質酸治療膝骨關節炎是安全有效的,並在1年隨訪中提供持續的臨床改善 [1]。
26名患者臨床實踐:
冷凍保存的胎盤間充質幹細胞,顯著改善膝骨關節炎
這項臨床試驗的原材料是冷凍保存的人胎盤間充質幹細胞(hP-MSCs)。
該研究採用非隨機化、開放標籤設計,共納入26名II-III期KOA患者,分為對照組(僅接受透明質酸治療)和MSC組(接受透明質酸聯合hP-MSCs治療)。
經過三次關節腔內注射(每次間隔4周),並對患者進行為期1年的隨訪觀察。
研究結果顯示:
1.安全性良好:首先是安全性問題,在治療過程中實驗組並未觀察到嚴重不良反應,僅部分患者出現輕度疼痛、腫脹等短暫不適,且均在數日內自行緩解。
2.療效顯著:其次是治療效果,與對照組相比,MSC組患者在6個月和1年時的WOMAC評分和VAS評分顯著降低,表明關節疼痛、僵硬及功能障礙得到顯著改善。
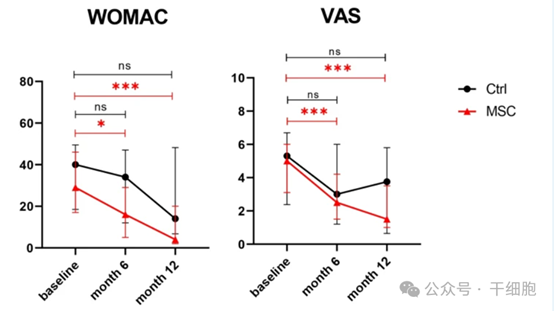
(圖片來自參考文獻1)
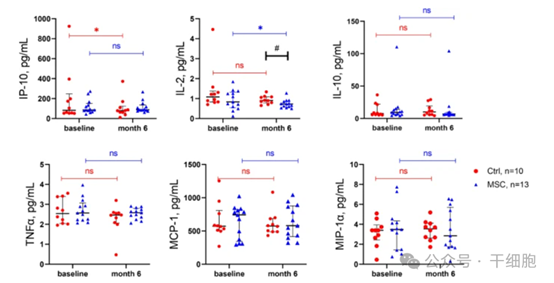
(圖片來自參考文獻1)
然而,MRI分析未發現兩組患者在軟骨厚度和光學密度指數上的顯著差異,這可能與治療時間較短或樣本量較小有關。
多項臨床證實:幹細胞治療骨關節炎具有多重益處
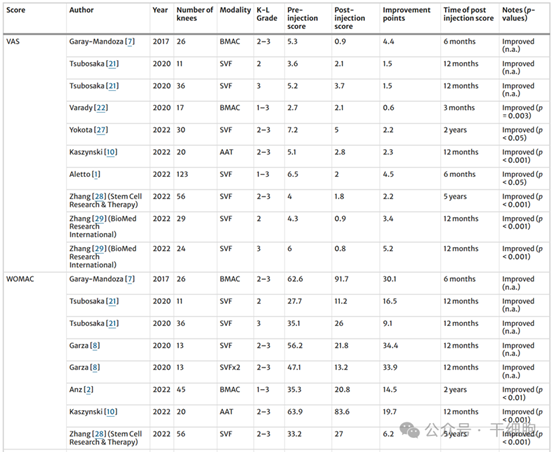
無獨有偶,此前,發表在“Journal of Experimental Orthopaedics”上的一篇名為“Stem cells for the treatment of early to moderate osteoarthritis of the knee: a systematic review”的綜述就也總結了近些年來幹細胞療法在OA上的臨床益處。

(圖片來源於參考文獻3)
大多數研究中研究者們都使用VAS評分進行疼痛緩解的評估,另外有六項臨床研究使用了骨關節炎指數(WOMAC)進行疼痛緩解的評分。
(圖片來源於參考文獻3)
由以上的結果我們不難看出,經過3個月~5年時間不等的隨訪,經由幹細胞注射後患者的疼痛評分大部分都有著顯著下降,改善幅度在0.9至5.2分之間,這意味著患者的疼痛得到了顯著的緩解。
2.功能改善方面
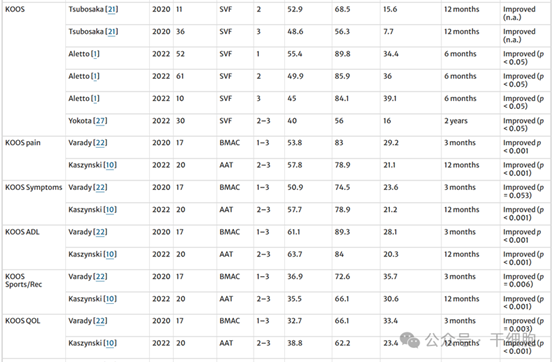
在評判臨床治療OA療效方面,除了對於疼痛的緩解之外,機體功能的改善也是很重要的一點,膝關節功能的改善是衡量治療效果的重要指標。
研究者匯總了近6年來的研究資料,主要結果如下圖所示,研究者主要採用了膝關節損傷和骨關節炎結局評分(K.O.O.S.)、膝關節臨床功能評分(K.S.S.)、EQ-5D-5L問卷和影像學分析等資料來對膝關節功能改善做出較為客觀的分析。
(圖片來源於參考文獻3)
結果顯示,經過幹細胞治療後,患者的膝關節功能評分顯著提升,膝關節的內翻機械軸從1.5°提高到1.8°,骨髓病變大小從123.5 mm^2減小到90.3 mm^2,而用於檢查軟骨修復的MOCART評分也從46.5提高到57.1,以上證據都表明幹細胞療法治療後患者膝關節的靈活性和活動能力都得到了不同程度的改善。
3.安全性良好
研究者匯總了12篇文獻,共統計了539名OA患者,其中有4例患者注射完幹細胞之後出現注射部位周圍疼痛,抽吸部位輕微出血的症狀,僅有2例患者出現了注射部位周圍輕微發紅或腫脹的症狀。從以上結果可以看出,幹細胞治療的安全性較高,且沒有發現嚴重的不良反應。
間充質幹細胞改善膝骨關節炎的優勢
膝骨關節炎是一種以關節軟骨退化、軟骨下骨異常為特徵的慢性疾病,主要表現為關節疼痛、僵硬、腫脹及活動受限。
據統計,全球約有5.28億人受此病困擾,且隨著年齡的增長,患病率還在顯著上升。傳統治療方法如非甾體抗炎藥、糖皮質激素注射及關節置換術等,雖能暫時緩解症狀,但長期效果有限,且可能帶來一系列副作用,如胃腸道不適、感染風險增加等。
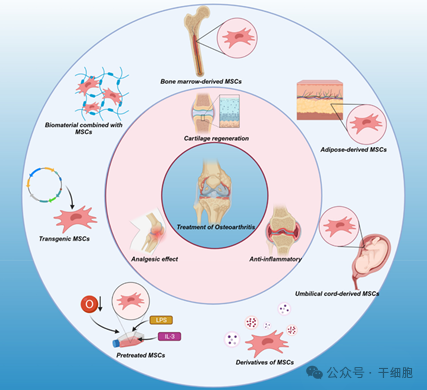
幹細胞療法,特別是間充質幹細胞的應用,為KOA的治療開闢了新的途徑。
(圖片可見參考文獻2)
如上圖所示,MSCs具有多向分化潛能,能夠分化為軟骨細胞、成骨細胞等,可以直接參與受損關節組織的修復與再生。此外,MSCs還具有免疫調節和抗炎作用,能夠減輕關節炎症,改善關節微環境,從而促進軟骨修復。
與傳統治療方法相比,幹細胞療法具有以下顯著優勢:
1.精准修復:MSCs能夠定向遷移至受損部位,通過分化為軟骨細胞直接參與軟骨修復,提高治療效果。
2.抗炎作用:MSCs通過分泌多種抗炎因數,減輕關節炎症,緩解疼痛,改善關節功能。
3.安全性高:幹細胞療法採用自體或異體幹細胞,來源廣泛,且經過嚴格篩選與培養,確保治療的安全性。
小結
近年來,幹細胞為膝骨關節炎帶來了全新的選擇。未來,仍需開展更多的研究來推動其更為廣泛的臨床應用,比如,幹細胞來源、製備工藝及品質控制需進一步優化,以確保治療的安全性和有效性。其次,仍需大規模、多中心、隨機對照試驗進行長期療效的進一步探討。
隨著科學技術的不斷進步和臨床研究的深入,幹細胞改善膝骨關節炎更多高品質的研究成果有望湧現,為膝骨關節炎帶來更加安全、有效的改善方案。
参考文献:
[1]Holiuk, Y., Birsa, R., Bukreieva, T. et al. Effectiveness and safety of multiple injections of human placenta-derived MSCs for knee osteoarthritis: a nonrandomized phase I trial. BMC Musculoskelet Disord 26, 418 (2025).
https://link.springer.com/article/10.1186/s12891-025-08664-2#Abs1
[2]Chen Y, Cheng RJ, Wu Y, Huang D, Li Y, Liu Y. Advances in Stem Cell-Based Therapies in the Treatment of Osteoarthritis. Int J Mol Sci. 2023 Dec 28;25(1):394. doi: 10.3390/ijms25010394. PMID: 38203565; PMCID: PMC10779279.
外泌體塗抹在皮膚上的效果已經讓大家見識到了它的神奇——它能幫助修復肌膚、抗衰老。但外泌體的神奇之處遠不止於此!科學家們發現,外泌體不僅能作用於皮膚,它在治療各種疾病時也大有作為。隨著技術的發展,幹細胞外泌體的給藥方式越來越多樣,從靜脈注射、局部注射,甚至是通過鼻滴或霧化吸入,都能將這種“修復高手”送到身體的不同部位,精准治療各種病症——
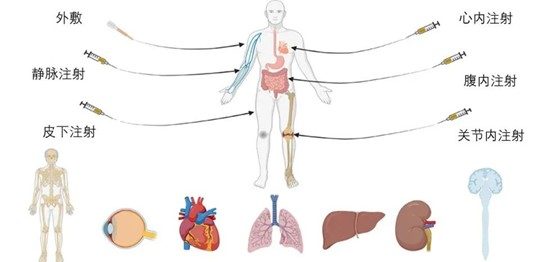
1靜脈給藥
全身治療的快速通道
靜脈給藥是一種通過直接注射藥物進入血液迴圈的方式,它可以讓幹細胞外泌體迅速進入全身,治療廣泛性疾病或需要全身調節的健康問題。這種方法常用於治療需要系統性治療的全身性疾病:如肝臟疾病、脾臟疾病、腎病及糖尿病等
臨床應用:靜脈給藥常用于阿爾茨海默症、帕金森病等神經系統疾病的治療。外泌體通過靜脈進入血液後,可以穿越血腦屏障,修復受損的神經元,減緩疾病進程。此外,它也適用於某些免疫系統疾病,通過外泌體調節免疫反應,恢復正常的免疫功能。
優勢:靜脈給藥能夠迅速將外泌體分佈到全身各個器官和組織,尤其適合全身性疾病的治療。藥效迅速,能夠實現廣泛的修復作用。

2023年發表於 Pharmaceutics 的一項研究中,科學家將間充質幹細胞來源的外泌體(MSC-EVs)用一種螢光脂溶性染料DiR標記,並通過靜脈注射(IV)、氣管內注射(IT)以及鼻內滴注(IN)方式給藥於BALB/c小鼠體內。研究發現—
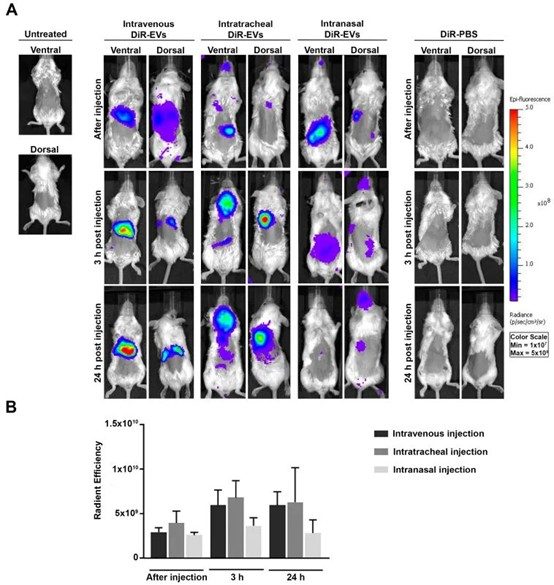
2局部給藥
精准治療局部病變
局部給藥是將幹細胞外泌體直接注射到受損的局部區域。這種方式通常適用於治療局部疾病,能夠讓藥物集中作用於病灶區域,效果更加顯著且副作用較小。
腰椎穿刺、顱內注射、皮下給藥、腹膜內給藥都屬於局部給藥。
臨床應用:局部給藥在關節炎、皮膚創傷、軟組織損傷等方面應用廣泛。例如,在關節炎患者中,局部注射幹細胞外泌體可以直接作用於損傷的關節軟骨,緩解炎症,促進修復。在皮膚創傷或燒傷的治療中,外泌體可以幫助促進新細胞生長,加速傷口癒合。
優勢:局部給藥可以將治療藥物直接送達病灶,最大限度地提高治療效果。相比全身給藥,它的副作用較小,且可以確保藥物集中作用於需要治療的區域。

2024年,Stem Cell Research & Therapy 發表了一篇關於脊髓損傷患者局部注射 UC-MSCs外泌體的臨床Ⅰ期試驗,該試驗招募了9例亞急性完全性脊髓損傷患者,發現鞘內注射同種異體 HUC-MSCs 外泌體,結果安全,耐受性良好。沒有觀察到研究干預引起的早期或晚期不良事件。
3霧化吸入
直接作用於肺部,快速改善呼吸功能
霧化給藥是一種將幹細胞外泌體轉化為霧化氣霧,通過呼吸道吸入的方法。這種方式適用於呼吸系統疾病,能夠將外泌體直接送達肺部,減少肺部炎症,促進肺組織修復。
臨床應用:霧化給藥主要用於治療慢性阻塞性肺疾病(COPD)、哮喘、支氣管炎等肺部疾病。通過霧化吸入,外泌體能夠直接作用於肺部的氣道和肺泡,幫助緩解呼吸道炎症,改善肺功能,促進肺組織的再生。
優勢:霧化給藥能夠通過呼吸道直接送達肺部,藥物作用迅速且局部濃度高。與口服或靜脈給藥相比,霧化給藥對肺部的直接作用更加精准,副作用更少,患者接受度較高。

2020年,發表於 Science Advances 的 文章支持了非侵入性的肺部顆粒給藥
(如霧化吸入)用於治療自身免疫疾病。研究表明:
4鼻內給藥
輕鬆穿越鼻腔,直接修復大腦
鼻內給藥是一種通過鼻腔將藥物送到大腦的給藥方式。鼻腔與大腦之間有直接的通道,藥物可以通過鼻腔迅速進入中樞神經系統,繞過血腦屏障,達到治療神經系統疾病的效果。
臨床應用:鼻內給藥主要用於中樞神經系統疾病的治療,如阿爾茨海默症、帕金森病、抑鬱症等。幹細胞外泌體通過鼻腔進入大腦後,可以幫助修復神經元,減緩或逆轉神經退行性疾病的進程。同時,鼻內給藥也有助於調節大腦中的神經傳遞,改善認知功能。
優勢:鼻內給藥的最大優勢是能夠繞過血腦屏障,直接將治療物質送入大腦,治療效果顯著。而且鼻腔給藥簡單方便,患者易於接受,操作相對安全。

2022年 Front. Bioeng. Biotechnol. 上發表的一篇關於外泌體安全性的文章表明了鼻噴的優勢:
作為非侵入性方式,更容易被患者接受,尤其適合需要中樞神經系統干預的場景。
寫在最後
研究人員通過專業的“活體成像設備”追蹤這些外泌體的動向,觀察它們去哪兒了、停留了多久,從而幫助判斷哪種給藥方式更適合不同的治療目標。研究表明,這四種幹細胞外泌體給藥方式各有優勢,能夠針對不同類型的疾病和治療需求提供精准的治療選擇。無論是靜脈給藥、局部給藥、鼻內給藥,還是霧化給藥,都能根據患者的具體病情,為其提供最佳的治療效果。隨著外泌體技術的不斷進步,這些給藥方式將在未來的臨床應用中發揮越來越重要的作用。
近年來,以CAR-T為代表的免疫細胞療法已經在血液腫瘤治療領域取得了顯著進展。然而,CAR-T療法在實體瘤治療中面臨的靶點缺失等局限性,促使科學家探索新的研究方向。在此背景下,CAR-NK細胞療法作為一種新興的免疫細胞療法,逐漸受到全球醫學界的高度關注。近日,美國羅格斯大學劉東方團隊發表的一項關於CD147 CAR-NK治療實體瘤安全性的研究成果引起廣泛關注。研究的結果顯示,針對肝癌模型,CD147 CAR-NK在體內外均表現出顯著的安全性優勢,尤其是神經毒性方面更是表現出極低的有限毒性。這一結果首次為CAR-NK療法的臨床轉化提供了關鍵安全性資料。
CAR-NK細胞療法有哪些核心優勢?
CAR-NK細胞療法是一種新型的免疫療法,它通過基因工程技術將特定的抗原受體(CAR)引入自然殺傷細胞(Nature killer cell,NK)中。NK細胞是人體天然免疫系統的第一道防線,能夠迅速回應並殺死異常細胞。通過CAR技術,NK細胞可以識別特定的腫瘤抗原,從而更精准地攻擊腫瘤細胞。
來源廣泛
無需自體NK細胞,使用現有的NK92細胞系、外周血、臍帶血和誘導多能幹細胞(iPSC)即可大規模生產CAR-NK細胞。
更高的臨床安全性
CAR-NK細胞的壽命較短,從安全性角度而言,這種特性避免了其長期存在於人體可能導致的一系列未知的風險。同時,CAR-NK療法幾乎不會引起細胞因數釋放綜合征(CRS)和神經毒性,且臨床試驗表明無需擔心移植物抗宿主病(GVHD)。
天然的抗腫瘤毒性
經過CAR修飾的NK細胞,保留了通過天然受體識別、靶向異常細胞的內在能力,使異常細胞很難通過下調CAR靶向抗原而逃脫,從而可以避免發生腫瘤逃逸。此外,CAR-NK細胞還可以通過CAR依賴和NK細胞受體依賴的多種作用機制,有效清除某些不表達CAR靶向抗原的異質性腫瘤。
通用性和可及性
NK細胞來源廣泛,使用現有的NK92細胞、外周血、臍帶血和誘導多能幹細胞(iPSC)即可大規模生產CAR-NK細胞。因而,臨床有望大幅縮短生產時間,提供一種“現貨且即用型”產品,且價格相對更低廉,更易被接受。
臨床研究進展概覽
據Clinicaltrials.gov顯示,CAR-NK療法治療癌症相關臨床資訊記錄顯示超100項,適應症覆蓋血液瘤和實體瘤、自免等疾病領域。
▲ CAR-NK細胞療法管線
從管線佈局來看,國內外企業在CAR-NK療法的適應症選擇上呈現出差異化特徵。國外企業多聚焦在血液瘤領域的深度開發,而國內企業則更多押注實體瘤領域的突破。這種差異一定程度上反應了市場需求與技術積累的差異,也展現了CAR-NK在不同疾病領域的應用潛力。同時,除腫瘤以外,國內外均在積極探索自身免疫性疾病等其他領域的創新藥物開發。
血液瘤:技術積墊下的靶點深挖
在血液瘤領域,以Fate、Century、Nkarta為代表的國外企業,將CAR-NK的研發火力集中於多發性骨髓瘤、B細胞淋巴瘤等領域,且呈現出靶點聚集。這些管線的核心優勢在於技術複用性高,血液瘤靶點(如CD19、BCMA)的生物學機制相對明確,CAR-NK可以借鑒CAR-T的成功經驗快速推進。
國內也有一部分企業在血液瘤領域佈局有管線,進展稍快的企業包括英百瑞、先博生物和傳奇生物,其相關管線均已進展至1期臨床,其他大多數企業的管線還處於臨床前或IIT研究階段。可以看到,國內企業在血液瘤佈局的管線不管是在靶點選擇,還是在雙靶點技術層面都呈現出創新化優勢。以IBR733為例,官方新聞稿指出,其是一款全球創新的CD33/CLL1雙特異抗體與NK細胞複合偶聯的產品,是國內首例非病毒非基因修飾方法的“現貨型”異體來源的CAR-raNK,其產品結構和治療方法均為國際首創。
實體瘤:國內企業的差異化突圍
在實體瘤治療領域,其臨床進度總體上相較於血液瘤相對緩慢,僅有少部分候選藥物進入臨床階段。但可以看到,佈局實體瘤賽道的企業數量一直在增加,適應症也覆蓋了肺癌、肝癌、胃癌及乳腺癌等多種實體瘤。國內企業在實體瘤領域展現出更具開拓性的研究思路,肝癌、胃癌等亞洲高發癌種成為主攻方向,而Claudin18.2、GPC3等靶點因在實體瘤中高表達且安全性可控,正成為研發熱點。這類管線的亮點在於差異化的靶點選擇與本土化適應症佈局。
更值得關注的是,國內企業正探索通過CAR-NK與PD-1抑制劑等聯合療法,以打破實體瘤治療瓶頸。
自身免疫疾病:未被充分開發的“藍海”
在自身免疫疾病領域,CAR-NK的探索雖然處於早期,但是展現出一定的免疫調節潛力。國外以Fate、Century為代表,國內先博生物、恩瑞愷諾、榮穀生物等多家企業均在自身免疫疾病領域佈局有CAR-NK管線,涉及系統性紅斑狼瘡等多種疾病。相關資料顯示,全球自身免疫疾病治療市場一直處於增長趨勢,儘管已有藥品上市,但作用疾病不具備針對性、患者回應率低下、副作用大等問題,導致該領域仍存在大量未被滿足的臨床需求。
CAR-NK治療自免的底層邏輯在於,NK細胞具有天然免疫調節功能,同時CAR-NK的炎症因數釋放水準較低,一定程度可避免常見的細胞因數釋放綜合征(CRS),從而降低自免疾病治療中的免疫過度啟動風險。
這一領域的挑戰在於靶點驗證與機制研究不足。例如,如何更好地設計CAR結構以精准調控自身免疫反應?如何平衡免疫抑制與過度殺傷?
技術分化背後的邏輯?
這種國內外區域化創新格局的形成,本質上是資源稟賦與市場需求共同作用的結果。對於國外企業而言,血液瘤商業化路徑清晰,CAR-T的成功為CAR-NK提供了快速複製的範本;而國內的實體瘤患者基數龐大,且傳統療法療效有限,倒逼企業尋求突破,進而催生了差異化的臨床開發策略。儘管路徑不同,CAR-NK的目標仍是解決未滿足的臨床需求。對於國內企業而言,在實體瘤領域的創新優勢需轉化為臨床資料,得到國際認可;而國外企業若想在CAR-NK開發上保持領先,則需要在血液瘤之外拓展適應症邊界。
挑戰與臨床轉化難點
CAR-NK細胞療法在腫瘤免疫治療領域展現出了廣闊的應用前景,尤其是從血液腫向實體瘤及自免疾病等領域拓展的過程中。儘管仍面臨諸多挑戰,但國內外企業正積極尋求突破。
首先是持久性與安全性的平衡。在缺乏細胞因數支援的情況下,持久性不足是CAR-NK療法的主要問題之一。雖然它可能更安全,但它也會限制NK細胞免疫治療的效果。外源性細胞因數已被證明能增加NK細胞的增殖和耐久性,然而,它們也可能導致一些副作用,包括抑制性免疫亞群的生長,如Tregs。
此外,精准識別最佳靶抗原是提升療效、減少脫靶效應的關鍵。NK細胞歸巢到腫瘤部位的效率一直存在爭議。過表達特定趨化因數受體的工程化CAR-NK細胞可以支援CAR-NK細胞更熟練地歸巢至腫瘤組織。
複雜的免疫抑制腫瘤微環境也是影響CAR-NK細胞發揮效力的主要障礙。實體瘤細胞外基質的緻密結構會影響CAR-NK的浸潤效率;TGF-β等抑制因數也會顯著削弱NK細胞的殺傷活性。通過引入NK特異性共刺激信號域增強啟動閾值、聯合光熱療法提升穿透能力等策略,有望克服這一挑戰。
新興技術驅動CAR-NK反覆運算升級
CAR-NK療法的未來發展需要與新興技術深度融合。其中,iPSC技術正重塑CAR-NK的研發范式,成為其規模化應用的核心驅動力。iPSC技術自2006年誕生以來,憑藉其無倫理爭議、無限增殖、多向分化等優勢,成為藥物研發領域的一大突破。與傳統NK細胞來源(如外周血或臍帶血)相比,iPSC衍生的NK細胞具有同質性強、無限擴增和基因編輯便捷的優勢,可標準化生產“現貨型”產品。此前,2025年1月,Cell子刊 Cell Reports Medicine上發佈了一項重磅研究成果。中國科學家團隊開發出全球首個四重基因編輯的iPSC來源CD70-CAR-NK細胞療法(70CAR-iNK)。該CAR-iNK療法可以有效靶向腫瘤細胞和同種異體 T 細胞,同時實現廣泛的腫瘤類型覆蓋、優越的增殖能力、增強的抗體依賴的細胞毒性作用(ADCC)以及對同種異體 T 細胞排斥反應的抵抗,在克服目前細胞治療的局限性方面具有巨大潛力。未來,iPSC技術與基因編輯、AI預測模型的結合將進一步提升CAR-NK的功能設計。
除了新興技術進一步賦能CAR-NK之外,其與CAR-T等多種療法聯合治療策略的協同效應也將成為突破實體瘤的關鍵路徑之一。CAR-NK與CAR-T的序貫使用,可形成“先天免疫+適應症免疫”的互補優勢;聯合PD-1抑制劑與介入化療,則可從多維度突破腫瘤防禦,增強CAR-NK療法綜合療效。
結語
總的來說,作為一種新型的細胞免疫療法,CAR-NK細胞療法展現出廣闊的應用前景和巨大的發展潛力。不過,目前CAR-NK大多還處於早期臨床及臨床前階段,很多技術尚在探索,還需要積攢更多的臨床試驗資料。
中性粒細胞衍生的囊泡抑制補體啟動發揮抗炎作用
Hsu, A. Y., et al. (2025). “Neutrophil-derived vesicles control complement activation to facilitate inflammation resolution.”
Cell. IF=45.6
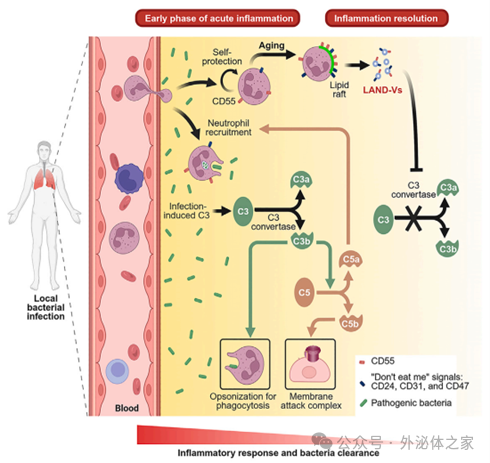
前期報導:【Cell】中性粒細胞衍生的囊泡抑制補體啟動發揮抗炎作用
腫瘤免疫中的細胞外囊泡
Kuang, L., et al. (2025). “Extracellular vesicles in tumor immunity: mechanisms and novel insights.”
Mol Cancer 24(1): 45.IF=27.7
細胞外囊泡在腫瘤發展和免疫逃逸機制中表現出雙重作用。EVs 可以通過削弱免疫細胞功能或調控免疫抑制通路,説明腫瘤細胞逃避免疫監視和攻擊,從而促進腫瘤的進展和轉移。相反,EVs 也可以運輸和釋放免疫調節因數,刺激免疫系統的啟動和調控,增強機體對抗惡性疾病的能力。EVs 的這種雙重功能為腫瘤免疫治療提供了有前景的方向和靶點。通過研究 EVs 的生物學特性及其對腫瘤免疫的影響,可以開發出新的治療策略,以提高癌症治療的效果和相關性。本綜述闡明了 EVs 在腫瘤免疫調節中的複雜作用,並探討了其在癌症治療中的潛在應用,旨在為未來基於EVs 的癌症免疫治療策略的進步奠定理論基礎並提供實踐見解。
炎症觸發的Gli1(+)幹細胞通過細胞外囊泡啟動異常中性粒細胞,加劇牙周免疫病理學
Cai, X. Y., et al. (2025). “Inflammation-triggeredGli1(+) stem cells engage with extracellular vesicles to prime aberrant neutrophils to exacerbate periodontal immunopathology.”
Cell Mol Immunol. IF=21.8
牙周炎是一種常見且逐漸惡化的疾病,其特徵是慢性炎症,其免疫病理機制尚未完全闡明。間充質幹細胞(Mesenchymal Stem Cells, MSCs)作為免疫調節因數,在維持組織穩態和再生中起著關鍵作用,但它們在免疫病理學和牙周組織退化中的體內功能仍不清楚。該研究利用多種轉基因小鼠模型,特異性標記、消融和調控Gli1(+)細胞(牙周組織中一類關鍵且具有代表性的MSCs亞群),以探討其在牙周免疫病理學中的具體作用。研究表明,Gli1(+)細胞在炎症微環境的挑戰下,可顯著誘導中性粒細胞的快速遷移和異常啟動,從而加劇牙槽骨的破壞。在機制上,Gli1(+)細胞釋放的細胞外囊泡(Extracellular Vesicles, EVs)作為牙周組織中的關鍵免疫調節因數,通過增強中性粒細胞活性氧(ROS)的生成以及刺激核因數κB(NF-κB)信號通路,介導了中性粒細胞的募集和啟動。此外,炎症刺激下Gli1(+)細胞來源的EVs表面暴露了CXC基序趨化因數配體1(CXCL1),通過CXCL1-CXC基序趨化因數受體2(CXCR2)軸啟動異常的中性粒細胞。重要的是,特異性抑制Gli1(+)細胞的EV釋放或使用GANT61進行藥物治療,可以改善牙周炎症和牙槽骨喪失。總之,該研究發現了Gli1(+)細胞在炎症條件下調控中性粒細胞浸潤和促進其異常啟動的全新作用,這為牙周炎的病理機制提供了新的見解,並提出了潛在的治療靶點。
修復肌腱病中的肌腱微環境——通過可注射肌腱水凝膠和肌腱來源幹細胞外泌體實現巨噬細胞調節和肌腱再生
Li, D., et al. (2025). “Restoring tendon microenvironment in tendinopathy: Macrophage modulation and tendon regeneration with injectable tendon hydrogel and tendon-derived stem cells exosomes.”
Bioact Mater 47: 152-169.IF=18
肌腱病是一種常見的肌肉骨骼疾病,其中相當一部分患者無法獲得有效的治療效果。炎症反應的程度以及膠原合成代謝的動態變化是影響肌腱內在自我修復能力的關鍵因素。然而,肌腱內的微環境較差,顯著阻礙了肌腱病的自我修復過程。該研究使用了一種可注射的肌腱來源去細胞外基質(tendon-derived decellularized extracellular matrix, tdECM)水凝膠來治療肌腱病。與膠原水凝膠相比,這種水凝膠提供了更具細胞相容性的微環境,同時保留了原生肌腱細胞外基質(ECM)的某些生物活性因數。值得注意的是,本研究首次發現tdECM水凝膠能夠促進M2型巨噬細胞的極化,從而在體內發揮抗炎作用。此外,將tdECM用作肌腱來源幹細胞外泌體(TDSCs-Exos)持續釋放的載體,通過體內和體外研究發現,tdECM水凝膠與外泌體結合後,在調節炎症、促進M2型巨噬細胞極化以及增強肌腱再生和修復效果方面表現出顯著的協同作用。這些結果表明,其作為一種治療肌腱疾病的潛在策略具有良好的應用前景。
全集成離心微流控技術用於快速外泌體分離、糖鏈分析和即時診斷
Zhao, X., et al. (2025). “Fully Integrated Centrifugal Microfluidics for Rapid Exosome Isolation, Glycan Analysis, and Point-of-Care Diagnosis.”
ACS Nano.IF=15.8
循環系統中的外泌體在疾病的診斷和治療方面展現出相當大的潛力。然而,血液樣本的複雜性質和高度豐富的蛋白質的存在對快速有效地從血液中分離和功能評估外泌體構成了重大障礙。該研究介紹了一種配備兩個納米篩檢程式的全集成光碟實驗室設備,稱為iExoDisc,它能夠在45分鐘內自動從400微升的血液樣本中分離外泌體。通過整合血漿分離模組、高豐度蛋白去除模組和基於納米孔膜的總分離模組,所獲得的外泌體純度顯著提高(約3-6倍),與傳統的超速離心和聚合物沉澱方法相比。此外,成功地利用MALDI-TOF-MS和含有56種凝集素的凝集素微陣列,對來自臨床三陰性乳腺癌(TNBC)患者的外泌體進行了非靶向和靶向糖鏈分析。兩種方法的結果均表明,半乳糖基化和唾液酸化可能作為TNBC的診斷指標。最後,通過利用外泌體特異性糖基化蛋白CD63作為概念驗證,成功實現了在2小時內集成即時晶片上的外泌體分離和原位檢測。因此,iExoDisc為早期癌症檢測、液體活檢和即時診斷提供了一種潛在的方法。
抗電場氣泡增強的無需清洗細胞外囊泡表面標誌物分析
Zhang, Y., et al. (2025). “Electric Field-Resistant Bubble-Enhanced Wash-Free Profiling of Extracellular Vesicle Surface Markers.”
ACS Nano. IF=15.8
對迴圈中的細胞外囊泡(EVs)進行高效分析有助於無創癌症診斷和治療監測,但由於繁瑣的分離、多步驟清洗以及靈敏度較低的技術限制,實際應用受到阻礙。該研究報導了一種多功能氣泡技術,可實現自分離、無需清洗、單步驟且超靈敏的EV表面標誌物分析,用於肺癌的早期診斷和治療監測。在該檢測中,浮力主導的氣泡具有抗電場特性,能夠實現EV回應的電活性探針釋放,通過電流體動力納米剪切力增強雜交,自分離出電極介面以最小化電化學測量中的雜訊,並實現單步驟、無需清洗的EV分析。該檢測的靈敏度接近單個EV水準,對非靶向EV表現出高度特異性,並可追蹤藥物誘導的EV表型變化。進一步研究表明,該技術能夠以超過95%的準確率區分癌症患者與非癌症對照組的血漿樣本(n = 111),通過機器學習實現準確的早期診斷,並以高於常規臨床血清標誌物的準確性監測術前/術後療效。這種基於氣泡驅動的單步驟EV檢測提供了一種有前景的、無需清洗的定量工具,可用於臨床精准液體活檢。
外泌體中低水準的miR-224-5p通過上調S100A4導致結直腸癌對5-FU的耐藥性
Yan, Y. Y., et al. (2025). “Low miR-224-5p in exosomes confers colorectal cancer 5-FU resistance by upregulating S100A4.”
Drug Resist Updat 79: 101211. IF=15.8
本研究旨在探討結直腸癌(CRC)仲介導5-氟尿嘧啶(5-FU)耐藥的分子標誌物。結果發現,5-FU耐藥CRC細胞來源的外泌體可增強HCT-15細胞的耐藥性和惡性特性。雙重篩選顯示,miR-224-5p在5-FU耐藥型中顯著下調,與S100A4蛋白上調相關。miR-224-5p直接靶向S100A4,其下調促進耐藥性和惡性特性,而上調可逆轉這些效應。此外,5-FU聯合維拉帕米通過調控miR-224-5p/S100A4通路逆轉耐藥性,雷公藤內酯通過該通路抑制惡性特性。miR-224-5p可作為預測和干預5-FU耐藥的分子標誌,雷公藤內酯或5-FU聯合鈣拮抗劑可作為耐藥患者的潛在治療策略。
四面體DNA納米結構修飾的工程化細胞外囊泡通過靶向GPX4增強口腔鱗狀細胞癌的治療效果
Wang, D., et al. (2025). “Tetrahedral-DNA-Nanostructure-Modified Engineered Extracellular Vesicles Enhance Oral Squamous Cell Carcinomas Therapy by Targeting GPX4.”
ACS Nano. IF=15.8
口腔鱗狀細胞癌(OSCC)是一種起源於口腔黏膜的異質性惡性腫瘤,目前主要治療方式包括手術、化療和放療,但5年生存率僅約50%。細胞外囊泡(EVs)作為藥物遞送平臺具有選擇性遞送小分子、核酸和蛋白質的潛力,而四面體DNA納米結構(TDNs)可促進藥物內吞和組織穿透。本研究通過將TDNs修飾於M1-EVs膜表面構建TDN@EVs,顯著提高了其生物穩定性和藥物遞送效率。體內外實驗表明,TDN@EVs抑制OSCC細胞增殖和遷移,促進凋亡,並具有優異的藥物穿透性。蛋白質組學分析發現Hsc70是其抗腫瘤活性的關鍵蛋白,通過TDN@EVs高效遞送至腫瘤細胞後,誘導GPX4降解,引發鐵死亡、線粒體應激和DNA損傷。TDN@EVs為OSCC治療提供了一種高效、安全的靶向遞送策略,展現出顯著的抗腫瘤效果和應用前景。
來源於微藻的細胞外囊泡與草本水凝膠協同作用,用於骨關節炎治療中的能量穩態調節
Liang, F., et al. (2025). “Microalgae-Derived Extracellular Vesicles Synergize with Herbal Hydrogel for Energy Homeostasis in Osteoarthritis Treatment.”
ACS Nano. IF=15.8
骨關節炎(OA)的治療因其複雜的病理微環境而具有挑戰性,該環境涉及活性氧、慢性炎症、線粒體功能障礙、能量缺乏和軟骨退化。本研究報導了從光合微生物螺旋藻中提取的細胞外囊泡(SP-EVs),其含有抗氧化和ATP依賴的活性及代謝相關化合物,用於OA治療。SP-EVs能有效遞送至軟骨細胞,調節細胞通訊和能量穩態。為了持續遞送SP-EVs,使用了大黃素水凝膠系統進行關節腔注射(Rh Gel@SP-EVs),在微酸性條件下表現出pH回應性和協同抗炎效果。Rh Gel@SP-EVs通過改善炎症介導的氧化應激和恢復線粒體膜電位,顯著改善了線粒體功能,促進ATP水準補充,平衡軟骨基質內的合成和分解過程,減緩OA進展。該策略利用基於微藻的草本水凝膠系統調節SP-EVs的持續釋放,通過調節能量代謝和抗炎機制,為OA治療提供了有效方法。
靜態拓撲線索結合動態流體刺激增強巨噬細胞外囊泡的產量及其在骨缺損治療中的潛力
Huang, H., et al. (2025). “Static Topographical Cue Combined with Dynamic Fluid Stimulation Enhances the Macrophage Extracellular Vesicle Yield and Therapeutic Potential for Bone Defects.”
ACS Nano. IF=15.8
該研究表明,結合靜態拓撲線索和動態流體刺激的3D列印灌注生物反應器可將巨噬細胞外囊泡(EVs)產量提高12.5倍,並通過上調miR-210-3p顯著增強其促進成骨分化和血管生成的生物活性,為EVs在骨缺損治療中的臨床轉化提供了一種可擴展、成本效益高且穩定的平臺。
表面雙樹枝狀磁性微纖維用於從微升級生物液體中快速分離細胞外囊泡並進行蛋白質組學分析
Chang, W., et al. (2025). “Surface Double Dendritic Magnetic Microfibrils for Rapid Isolation and Proteomic Profiling of Extracellular Vesicles from Microliters of Biofluids.”
ACS Nano. IF=15.8
該研究開發了功能化雙樹枝狀磁性微纖維(fDDMMs),用於從微升級生物液體中高效分離和蛋白質組學分析細胞外囊泡(EVs)。fDDMMs通過其多功能特性,實現了從1微升血漿樣本和100微升腫瘤類器官培養基中快速分離EVs和製備蛋白質組學樣本,為液體活檢和個性化醫學提供了巨大潛力。
利用點擊化學技術工程化的小型細胞外囊泡表達嵌合抗原受體,在急性肝功能衰竭中表現出增強的療效
Lu, Y. T., et al. (2025). “Small Extracellular Vesicles Engineered Using Click Chemistry to Express Chimeric Antigen Receptors Show Enhanced Efficacy in Acute Liver Failure.”
J Extracell Vesicles 14(2): e70044. IF=15.5
對乙醯氨基酚(APAP)過量可能導致嚴重的肝損傷和威脅生命的狀況,若未及時治療,可能引發多器官衰竭。N-乙醯半胱氨酸(NAC)是公認的用於APAP過量解毒的治療方法。然而,在急性肝衰竭(ALF)中,尤其是攝入量較大的情況下,NAC可能無法完全恢復肝功能。此外,NAC在ALF治療中存在局限性,並可能引發噁心、嘔吐、腹瀉、脹氣、胃食管反流和類過敏反應等不良反應。基於間充質基質細胞(MSC)旁分泌活性的療法在治療ALF方面展現出希望,已有臨床前研究表明其可改善病情。近年來,來源於MSC的細胞外囊泡(EVs)作為一種治療肝損傷的新選擇逐漸受到關注。MSC來源的EVs可根據來源細胞攜帶多種治療性貨物,參與生理過程並對異常情況作出回應。然而,大多數治療性EVs在進入體內後缺乏明確的方向性,導致靶向特異性不足。因此,迫切需要提高天然EV遞送系統的精准性。為此,該研究開發了一種先進的靶向技術,用於在體內遞送改良的EVs。該策略是利用生物正交點擊化學技術,將靶向分子附著到小型細胞外囊泡(sEVs)的表面,生成外源性嵌合抗原受體修飾的sEVs(CAR-sEVs)用於治療。首先,通過代謝糖工程技術,我們通過用含疊氮基的單糖N-疊氮乙醯甘露糖胺(Ac4ManNAz)處理MSC,製備了疊氮修飾的sEVs(N3-sEVs)。接著,將N3-sEVs與二苯並環辛炔(DBCO)標記的單鏈可變片段(DBCO-scFv)偶聯,該片段靶向去唾液糖蛋白受體(ASGR1),從而生成CAR-sEVs,實現對肝臟的精准靶向。通過靶向ASGR1驗證了CAR-sEV療法在ALF模型中的療效。MSC來源的CAR-sEVs降低了血清肝酶水準,減輕了肝損傷,並促進了APAP誘導損傷中的肝細胞增殖。總體而言,CAR-sEVs展現出增強的肝細胞特異性和治療肝損傷的療效,突顯了細胞外靶向療法的顯著進展。
由肝細胞癌中基質剛度調控的外泌體miRNAs觸發的葡萄糖富集型肺部轉移前微環境
Zhao, Y., et al. (2025). “A glucose-enriched lung pre-metastatic niche triggered by matrix stiffness-tuned exosomal miRNAs in hepatocellular carcinoma.”
Nat Commun 16(1): 1736. IF=14.7
除了經典特徵外,在肝細胞癌(HCC)轉移前微環境形成過程中是否存在其他新的病理特徵幾乎未知。之前的研究強調了基質剛度增加對HCC中肺部轉移前微環境形成和轉移的貢獻。然而,基質剛度增加是否影響肺部轉移前微環境的葡萄糖代謝和供應仍然很不清楚。該研究揭示了基質剛度調控的外泌體miRNAs作為主要貢獻者,通過減少肺成纖維細胞的葡萄糖攝取和消耗,同時增加血管生成和血管通透性,從而在肺部轉移前微環境形成過程中調節葡萄糖富集的潛在機制。研究表明,葡萄糖富集是由基質剛度調控的外泌體miRNAs觸發的肺部轉移前微環境的新特徵,對於轉移腫瘤細胞的定植、生存以及後續轉移灶的生長至關重要。
利用來源於再生新生兒心臟組織的細胞外囊泡進行心臟修復
Li, H., et al. (2025). “Cardiac repair using regenerating neonatal heart tissue-derived extracellular vesicles.”
Nat Commun 16(1): 1292.IF=14.7
新生哺乳動物的心臟在受損後能夠通過誘導心肌細胞增殖實現再生。然而,這種再生能力在成年哺乳動物心臟中幾乎消失。研究表明,細胞外囊泡(EVs)在心臟修復中發揮重要的心臟保護作用。本文報導,從再生的新生兒心臟組織中提取的細胞外囊泡(AR-Neo-EVs)在心尖切除手術後表現出比新生鼠心臟組織提取的細胞外囊泡(Neo-EVs)更強的促增殖、抗凋亡和促血管生成活性,而這些效果在成年鼠心臟來源的細胞外囊泡(Adu-EVs)中不存在。蛋白質組學分析顯示,AR-Neo-EVs中Wdr75蛋白(一種p53調節因數)的表達高於Neo-EVs。當Wdr75被敲低時,AR-Neo-EVs的再生潛力被削弱。研究進一步表明,通過海藻酸鈉水凝膠微球遞送AR-Neo-EVs是治療心肌梗死的有效方法。該研究展示了利用再生組織來源的細胞外囊泡觸發保護和再生機制的潛力。
HBV相關的肝細胞癌通過長鏈非編碼RNA HDAC2-AS2抑制抗腫瘤CD8(+) T細胞
Gao, Y., et al. (2025). “HBV-associated hepatocellular carcinomas inhibit antitumor CD8(+) T cell via the long noncoding RNA HDAC2-AS2.”
Nat Commun 16(1): 2055. IF=14.7
該研究發現HBV相關肝細胞癌通過腫瘤細胞分泌的細胞外囊泡攜帶的長鏈非編碼RNA HDAC2-AS2抑制腫瘤內CD8(+) T細胞的細胞毒性,從而促進腫瘤進展,並提出HDAC2-AS2可作為肝細胞癌的潛在生物標誌物和治療靶點。
胎盤通過外泌體中的PPARγ調控子宮內胎兒的生長
Luo, X., et al. (2025). “The Placenta Regulates Intrauterine Fetal Growth via Exosomal PPARγ.”
Adv Sci (Weinh): e2404983. IF=14.3
腫瘤細胞來源的細胞外囊泡對免疫逃逸的影響
Liu, X., et al. (2025). “Effect of Extracellular Vesicles Derived From Tumor Cells on Immune Evasion.”
Adv Sci (Weinh): e2417357. IF=14.3
本文審核專家:江蘇大學附屬醫院 李晶教授
引言
外泌體是再生醫學的一個新前沿,有助於疾病治療和健康長壽。根據文獻表明,鼻滴幹細胞上清液是一種安全、簡單的治療方法,可在家中進行。從對認知功能的改善效果來看,這種方案有可能成為治療阿爾茨海默病認知障礙的新療法。研究者對13名阿爾茲海默症患者進行了臨床試驗,資料顯示,間充質幹細胞外泌體經鼻給藥8周是安全的,並觀察到了Hasegawa癡呆量表-修訂版(HDS-R)評分的顯著增加。
神經認知障礙是影響健康壽命的重要障礙,在老齡化社會中,對神經認知障礙的研究日益深入。阿爾茨海默病(Alzheimer’s disease, AD)是導致認知障礙的原發疾病。
阿爾茲海默症是一種常見的神經退行性疾病,嚴重影響患者的認知功能和生活品質。儘管目前已有多種藥物用於治療阿爾茲海默症,但大多數藥物僅能延緩症狀的進展,無法從根本上解決問題。
近年來,幹細胞療法逐漸成為研究熱點,尤其是幹細胞外泌體(exosome)的應用,為阿爾茲海默症的治療帶來了新的希望。越來越多的臨床研究揭示,鼻滴幹細胞外泌體有望成為阿爾茲海默症的新選擇。外泌體治療是再生醫學的一個新前沿,有助於疾病治療和健康長壽。
最近,一項來自日本的研究探討了幹細胞上清液鼻腔給藥治療阿爾茲海默症的安全性和臨床效果。

研究人員得出以下結論:間充質幹細胞上清液經鼻給藥8周是安全的,並觀察到了Hasegawa癡呆量表–修訂版(HDS-R)評分的顯著增加。鼻滴幹細胞分泌體是一種安全、簡單的治療方法,可在家中進行。從對認知功能的改善效果來看,意味著這種方案有可能成為治療阿爾茨海默病認知障礙的新療法。
臨床方案:鼻滴幹細胞外泌體,每週3次,連續8周
成分:間充質幹細胞上清液凍乾粉,分泌組含量為1*10^8,其中HGF(肝細胞生長因數是主要的生長因數之一)含量:1.2 × 10^5 pg,包含多重高濃度生物活性物質如生長因數、神經營養物質等;
患者概況:研究團隊選取了13名阿爾茲海默症患者;
給藥途徑:通過鼻腔給予間充質幹細胞上清液,每週3次,持續8周;
評價指標:在研究前後,對受試者進行了HDS-R評分、血液檢查、激素水準測量以及MCI篩查測試等多項評估。
臨床研究結果:
鼻滴幹細胞外泌體使認知功能顯著改善
研究團隊使用Hasegawa癡呆量表-修訂版(HDS-R)評估患者的認知功能。
治療8周後,患者的HDS-R評分從15.6分提高到17.5分,顯示出顯著的認知功能改善。特別是在輕度至中度患者中,評分從17.2分提高到20.0分,效果更為顯著。
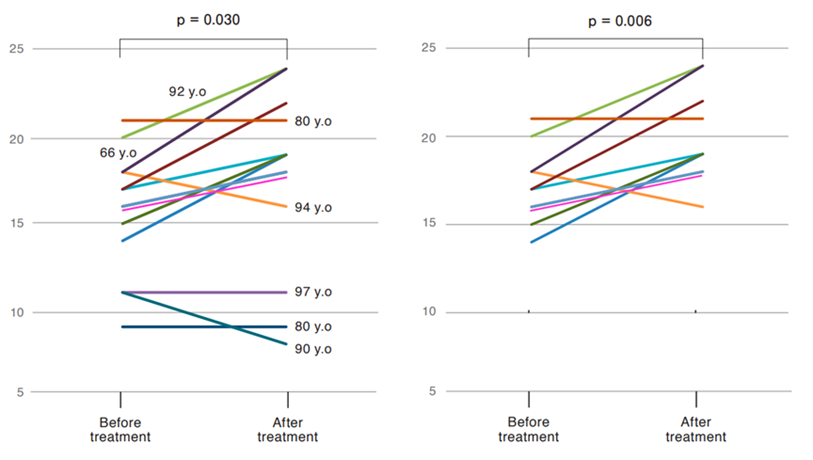
(圖片來自參考文獻2)
此外,血液檢查顯示,患者的血小板數量減少,白蛋白/球蛋白比例增加,低密度脂蛋白/高密度脂蛋白比例下降,這些變化可能與外泌體對代謝的調節作用有關。
MCI篩查測試還發現,與阿爾茲海默症相關的載脂蛋白A-1(ApoA1)水準顯著增加,ApoA1被認為能夠抑制β澱粉樣蛋白(Aβ)的聚集和毒性,從而改善認知功能。
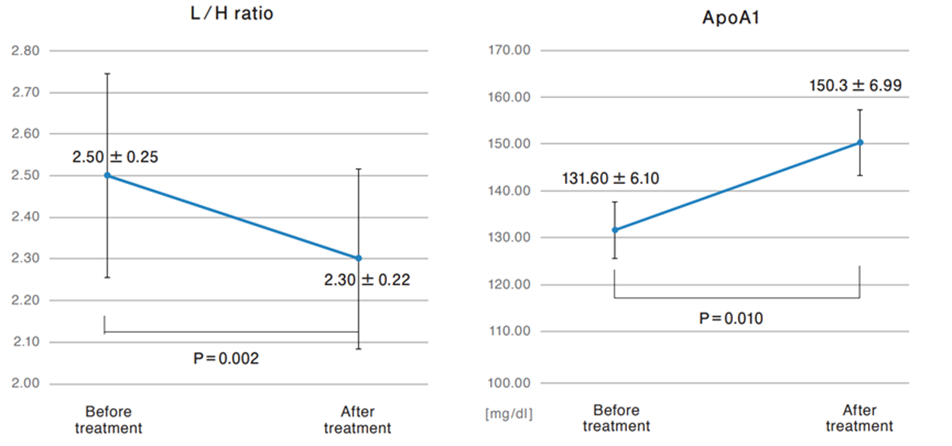
(圖片來自參考文獻2)
臨床研究結果:鼻滴幹細胞外泌體是安全的
在安全性方面,整個治療過程中,13名患者均未出現與治療相關的嚴重不良反應。鼻腔給藥幹細胞上清液顯示出良好的安全性,患者的生活品質得到了顯著提升。
幹細胞外泌體鼻滴的又優勢和潛力不斷得到證實
幹細胞外泌體是幹細胞分泌的一種微小囊泡,內含多種生物活性物質,如生長因數、細胞因數和微小RNA等。這些物質能夠調節細胞間的通訊,促進組織修復和再生。
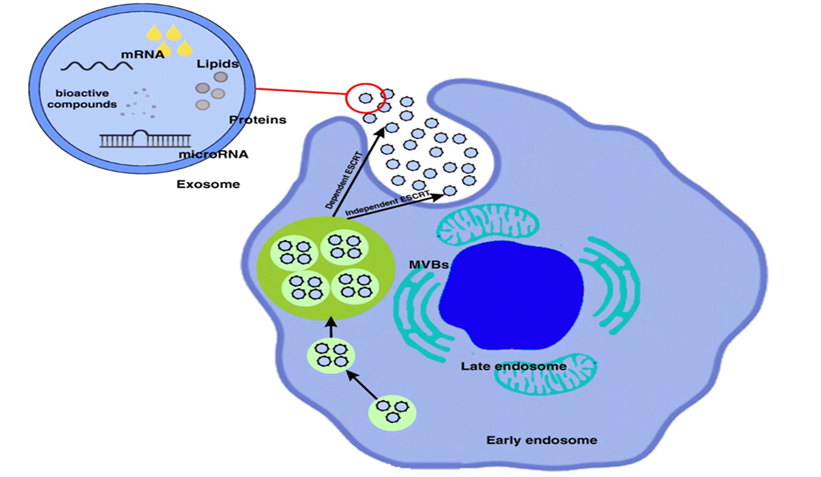
與傳統的幹細胞療法相比,幹細胞外泌體療法具有以下優勢:
1.安全性高:外泌體不含有活細胞,避免了免疫排斥和腫瘤風險。
2.易於儲存和運輸:外泌體可以冷凍保存,便於長期儲存和遠距離運輸。
3.多種給藥途徑:外泌體可以通過靜脈注射、皮下注射、鼻腔給藥等多種方式進入體內,使用方便。
鼻腔給藥是一種非侵入性的給藥方式,藥物通過鼻腔黏膜迅速吸收,能夠繞過血腦屏障,直接作用於大腦。對於阿爾茲海默症這種中樞神經系統疾病,鼻腔給藥具有獨特的優勢。
近年來,越來越多的研究團隊探討了幹細胞外泌體鼻滴的臨床潛力。去年,我國研究團隊也發佈了間充質幹細胞外泌體鼻噴治療阿爾茲海默症的臨床資料[3]。
該臨床試驗依據“3+3”設計原則,分為低、中、高三個劑量組,劑量分別為2×10^8、4×10^8和8×10^8。符合條件的參與者被逐一分配至不同劑量組,接受為期12周的干預治療,期間每週進行兩次鼻內給藥,並在治療結束後進行多次隨訪,時間節點包括第12、16、24、36和48周。
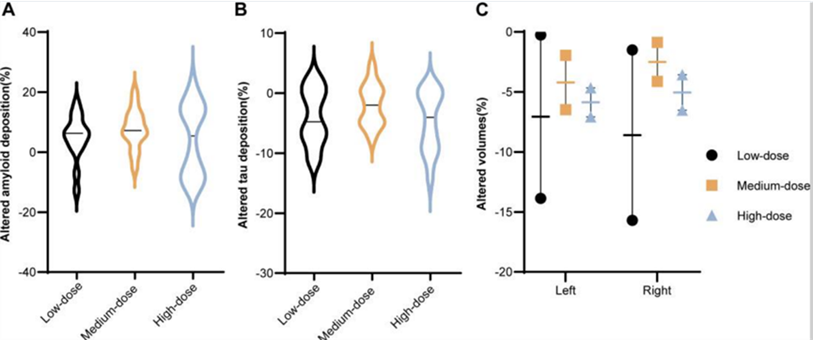
圖片來自參考文獻3)
主要試驗結果如上圖所示,所有參與者均未報告不良事件,且各項安全性評估指標(含生化檢查)均未見顯著異常。與基線相比,中等劑量組的ADAS-cog評分在第12周時下降了2.33(標準差為1.19),MoCA-B評分則增加了2.38(標準差為0.58),提示認知功能有所改善。值得注意的是,中等劑量組的ADAS-cog評分直至第36周仍持續下降,共計降低了3.98分。
此臨床試驗不僅驗證了間充質幹細胞外泌體鼻噴的安全性,還證實了參與者能夠耐受每週兩次的鼻內給藥方案,為後續臨床試驗的劑量選擇提供了重要參考。
小結
以上臨床研究資料令人鼓舞。通過這些資料我們可以看到,幹細胞外泌體經鼻給藥不僅安全,而且能夠顯著改善阿爾茲海默症患者的認知功能。未來,隨著更多大規模臨床試驗的開展,幹細胞外泌體有望成為一種新的阿爾茲海默症治療手段。然而,幹細胞外泌體療法仍面臨一些挑戰,如標準化生產、長期安全性評估等。此外,如何選擇合適的患者群體、優化給藥方案等均是未來研究需要考慮的問題。我們期待有更多的科臨床資料,推動這一療法的進一步發展,造福廣大阿爾茲海默症患者。
參考文獻:
[1] Fayazi, N., Sheykhhasan, M., Soleimani Asl, S. et al. Stem Cell-Derived Exosomes: a New Strategy of Neurodegenerative Disease Treatment. Mol Neurobiol 58, 3494–3514 (2021).
連結:https://doi.org/10.1007/s12035-021-02324-x
[2] Morita Y, Izawa H, Ohga H, et al. Safety and clinical efficacy on intranasal administration of mesenchymal stem cell-derived secretome in patients with Alzheimer’s disease and its future prospect[J]. Glycative Stress Research, 2024, 11(3): 103-110.
[3] Xie X, Song Q, Dai C, Cui S, Tang R, Li S, Chang J, Li P, Wang J, Li J, Gao C, Chen H, Chen S, Ren R, Gao X, Wang G. Clinical safety and efficacy of allogenic human adipose mesenchymal stromal cells-derived exosomes in patients with mild to moderate Alzheimer’s disease: a phase I/II clinical trial. Gen Psychiatr. 2023 Oct 11;36(5):e101143. doi: 10.1136/gpsych-2023-101143. PMID: 37859748; PMCID: PMC10582850.
連結:https://pubmed.ncbi.nlm.nih.gov/37859748/
相关推荐