原創: 奇點糕奇點網3天前
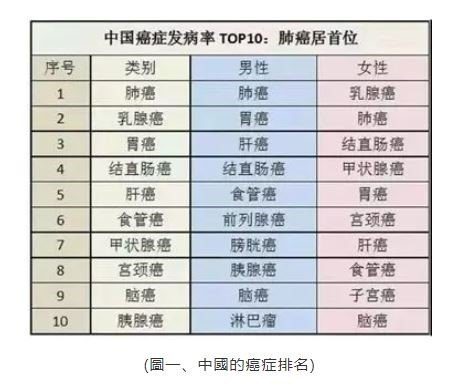
今年年初,有關檳榔的討論再次登上熱搜,通過一個個驚心觸目的病例,普通人終於發現原來身邊還有這麼一種可怕的疾病,口腔癌。其實,包括口腔癌在內的頭頸癌雖然並不總在話題中心,但兇殘卻並不遜於肺癌、肝癌等癌症大戶。
從臨床數據來看,頭頸癌病程獨特、患者預後差,與之相對的是有限的治療方法和多年來並無進展的生存率。如何突破桎梏,為頭頸癌患者尋一條新的出路是重要的問題。
近日,首個登陸中國的免疫檢查點抑製劑納武利尤單抗再獲中國國家藥品監督管理局批准擴大適應症,適用於治療接受含鉑類方案治療期間或之後出現疾病進展且腫瘤PD-L1表達陽性(表達PD-L1的腫瘤細胞≥1%)的複發性或轉移性頭頸部鱗癌(SCCHN)患者。
值得一提的是,本次獲批是基於全球III期臨床研究CheckMate 141,在沒有國內臨床試驗的情況下獲批,足見對新療法的迫切需求了。
頭頸癌到底有什麼魔力,值得如此關注?讓我們一同來了解這種特殊的、看得見的惡魔。
看得見的惡魔
頭頸癌是一大類癌症的總稱,指的是始於頭頸部如口、鼻、咽、喉、鼻竇和唾液腺等部位的腫瘤。
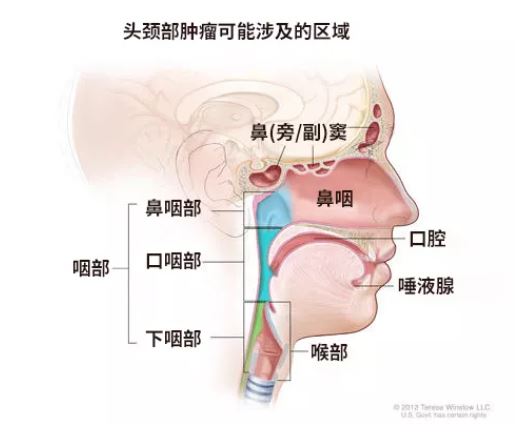
雖然看似小眾,但實際上頭頸癌並不罕見。根據世界衛生組織(WHO)報告,頭頸癌是第七大常見癌症,也是第九大致死癌症[1]。而在中國,每年約有13.5萬人患上頭頸癌,死亡病例約7萬 [2]。從癌細胞起源算起,超過90%的頭頸癌為鱗狀細胞癌(SCC)[3]。
頭頸癌的預後很大程度上取決於發病階段。早期患者通過手術、放療治療後預後良好,但是這樣的患者在臨床上只有不到三分之一,典型的頭頸癌病例發現時已經是晚期伴隨淋巴結轉移,放眼全球能實現5年生存的患者不到一半 [3]。
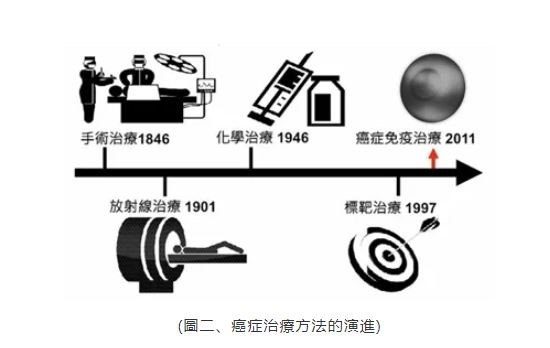
頭頸癌的治療方法以手術、放化療和靶向治療的結合為主,這就意味治療時很可能要在頭臉上動刀子。頭頸癌的特殊發生部位決定了患者必須得面對治療後面部的損傷,以及器官缺失帶來的一系列生活的不便。在諸多媒體報導中,頭頸癌患者被稱為“割面人”。

近二十年來,無論是手術還是放射治療技術都有了很大的進步,患者也得以最大程度地保有器官,但是縱使生活質量有了一些改善,但遺憾的是患者的生存率並沒有顯著的提高 [3]。
這就必須要提到頭頸癌的特殊病程了。頭頸癌極易發生復發/轉移或再發原發腫瘤,其中再發原發腫瘤是導致頭頸癌高死亡率的首要原因,它造成的死亡數比遠端轉移造成的死亡數高3倍 [4 ]。至於為什麼,我們下一節說。
頭頸癌治療遲遲沒有進展,我們對頭頸癌認知的局限必須背鍋。
前文提過,超90%的頭頸部癌症是鱗狀細胞癌,因而很長一段時間裡,科學家是把頭頸癌當作一種相對來說同質性比較高的疾病看待的。但是事實上,頭頸癌異質性很高,這全面影響了頭頸癌預後、治療決策和癌基因的識別。
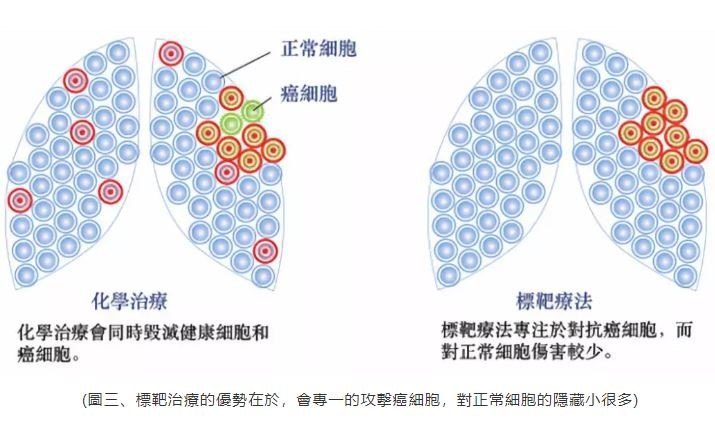
舉個簡單的例子,提到肺癌,你想到的是什麼?在免疫治療出現之前,毫無疑問,是EGFR、ALK等各種驅動基因和靶向藥,而這些都是基於對肺癌分子生物學的深入理解。在頭頸癌上也是一樣,知己知彼,才能找到製勝的方法。
縱覽近些年的相關研究,科學家們已經發現了一些有參考價值的臨床指標,包括EGFR突變[5]、高危HPV感染、核型[6]等等。但反觀頭頸癌多年沒有進展的生存率,想來目前的科學探索還是遠遠不夠的。
說到底,癌細胞的諸多變化賦予它們的是與免疫系統一爭高下的本事,而打贏這場戰爭,還是要回歸到免疫上。
不平衡的免疫戰爭
先回答之前留下的問題,為什麼頭頸癌這麼容易出現復發/轉移和再發原發腫瘤?
1953年,科學家們提出了一個新的概念,區域化癌變(field cancerization) [7]。他們檢查了很多口腔腫瘤標本,發現腫瘤周圍組織細胞頻繁出現異常,科學家認為這可能就是頭頸癌治療後高複發和多發原發腫瘤的原因。
分子生物學研究發現,這些區域化癌變與癌前病變不同,主要以遺傳學變化為基礎、宏觀上表現得很正常。當手術切除腫瘤的時候,區域化癌變往往位於切除部位的邊緣,成為留在患者體內的“火種” [8]。對患者進行的回顧性研究也證明了這一點[9]。

光有火種當然不夠,腫瘤最終形成還是要取決於它和免疫誰佔上風。
理想條件下,在腫瘤形成之前,新生的癌前細胞就會被免疫系統破壞,也就是所謂的免疫監視(immune surveillance)。癌細胞則有兩大手段來逃避免疫監視,第一降低自己的免疫原性,第二抑制抗腫瘤免疫。
癌細胞能夠通過多種方式“脫掉”被免疫細胞識別的人類白細胞抗原(HLA)[10],它們也能夠產生轉化因子、白介素等細胞因子,激活STAT1信號通路抑制細胞介導的抗腫瘤免疫[11]。除此之外,就是利用包括CTLA-4、PD-1、LAG3等在內的免疫檢查點。

頭頸癌正是一種非常典型的免疫抑制性癌症。
根據臨床數據,頭頸癌患者的淋巴細胞計數顯著低於正常人[12],NK細胞活性和抗原遞呈功能受損[13,14],腫瘤浸潤T淋巴細胞功能缺陷 [15]。
尤其是後者,是臨床治療預後不佳的重要影響因素[16]。
由此可見,免疫應該是戰勝頭頸癌的一道繞不開的關隘。
T細胞、癌細胞和PD-1/L1之間的恩怨情仇我們已經聊過不少,這裡就不再贅述了。已經在多個癌症大殺特殺的免疫治療,是否也能夠在頭頸癌領域取得一席之地呢?
承載希望的征程
對頭頸癌免疫治療的初步嘗試始於2014年,也就是文章最開始提到的CheckMate 141研究。
CheckMate 141是一項在全球範圍內進行的隨機3期臨床研究,旨在評估納武利尤單抗單藥對比標準治療針對含鉑治療失敗的複發/轉移頭頸鱗癌患者的有效性和安全性。研究共納入261名患者,隨機2:1分配。試驗組採用納武利尤單抗單藥治療,對照組則選擇標準治療,包括西妥昔單抗、甲氨蝶呤、多西他賽,由研究者擇一而用。
令人欣慰的是,這次我們終於迎來了久違的勝利。
在2015年底進行的中期分析中,納武利尤單抗單藥組的中位OS為7.5個月,1年OS率達到36%;反觀標準治療組,中位OS為5.1個月,1年OS率僅有16.6% [17]。根據這一漂亮數據,CheckMate 141宣布研究提前終止,納武利尤單抗拿到了歐盟和FDA的批文。
2018年,CheckMate 141的兩年隨訪數據公佈,結果更加振奮人心。相較標準治療,納武利尤單抗單藥可降低死亡風險32%,2年OS率幾乎是標準治療組的3倍 [18]!在持久穩定的生存獲益之外,納武利尤單抗的安全性也更好、嚴重不良反應更少。

免疫治療的2年OS幾乎達到標準治療的3倍
在衝破關隘迎來了頭頸腫瘤治療新篇章的同時,CheckMate 651中納武利尤單抗進一步聯手ipilimumab又向復發/轉移頭頸鱗癌的一線標準治療發起挑戰。此前我們也曾介紹過PD-1/L1與CTLA-4兩條通路存協同作用,二者在臨床治療上很可能相輔相成,且納武利尤單抗聯手ipilimumab已在黑色素瘤、腎細胞癌、結直腸癌以及非小細胞肺癌捷報頻傳。CheckMate 651是否進一步書寫傳奇,讓我們期待下一個好消息吧。
另外,免疫治療與放射治療的聯合應用也值得關注。此前已有研究者發現,放射治療在本身直接的細胞毒性作用之外,也會改變腫瘤的免疫表型,激活抗腫瘤免疫 [20]。在幾項早期臨床中,免疫治療聯合化療治療局部晚期頭頸癌的安全性已經得到證實[21],更進一步的III期研究也正在進行中,如果能夠進一步產生生存獲益,那麼對於那些無法耐受化療的患者來說意義重大。
包括新輔助治療在內,免疫治療已經在頭頸癌領域多點開花。之前我們常說,免疫治療正在顛覆整個肺癌治療格局,現在看來把它用在頭頸癌領域也同樣合適。
從認識免疫到擁有免疫治療藥物,科學走過了漫長的百年;現在是坐在巨人的肩膀上騰飛,希望免疫治療一飛沖天。
注:納武利尤單抗在中國大陸僅獲批非小細胞肺癌和頭頸部鱗癌相關適應症,ipilimumab尚未在中國大陸上市。
參考資料:
[1] World Cancer Report 2014. World Health Organization. 2014. pp. Chapter 5.8. ISBN 978-9283204299.
[2] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA: a cancer journal for clinicians, 2016, 66(2): 115-132.
[3] Leemans CR, Braakhuis BJM, Brakenhoff R H. The molecular biology of head and neck cancer[J]. Nature reviews cancer, 2011, 11(1): 9.
[4] Morris LGT, Sikora AG, Patel SG, et al. Second primary cancers after an index head and neck cancer: subsite-specific trends in the era of human papillomavirus–associated oropharyngeal cancer[J]. Journal of clinical oncology, 2011 , 29(6): 739.
[5] Chung, CH et al. Molecular classification of head and neck squamous cell carcinomas using patterns of gene expression. Cancer Cell 5, 489–500 (2004).
[6] Hermsen, M. et al. New chromosomal regions with highlevel amplifications in squamous cell carcinomas of the larynx and pharynx, identified by comparative genomic hybridization. J. Pathol. 194, 177–182 (2001).
[7] Slaughter, DP, Southwick, HW & Smejkal, W. Field cancerization in oral stratified squamous epithelium; clinical implications of multicentric origin. Cancer 6, 963–968 (1953).
[8] Tabor, MP et al. Persistence of genetically altered fields in head and neck cancer patients: Biological and clinical implications. Clin. Cancer Res. 7, 1523–1532 (2001).
[9] Schaaij-Visser, TBM et al. Differential proteomics identifies protein biomarkers that predict local relapse of head and neck squamous cell carcinomas. Clin. Cancer Res. 15, 7666–7675 (2009).
[10] Ferris R L. Immunology and immunotherapy of head and neck cancer[J]. Journal of clinical oncology, 2015, 33(29): 3293.
[11] Leibowitz MS, Andrade Filho PA, Ferrone S, et al: Deficiency of activated STAT1 in head and neck cancer cells mediates TAP1-dependent escape from cytotoxic T lymphocytes. Cancer Immunol Immunother 60:525-535, 2011.
[12] Kuss I, Hathaway B, Ferris RL, et al: Decreased absolute counts of T lymphocyte subsets and their relation to disease in squamous cell carcinoma of the head and neck. Clin Cancer Res 10: 3755-3762, 2004.
[13] Bauernhofer T, Kuss I, Henderson B, et al: Preferential apoptosis of CD56dim natural killer cell subset in patients with cancer. Eur J Immunol 33:119-124, 2003.
[14] Ferris R, Whiteside TL, Ferrone S: Clinical significance of downregulated antigen processing machinery in head and neck cancer. Clin Cancer Res 12:3890, 2006.
[15] Ferris RL: Progress in head and neck cancer immunotherapy: Can tolerance and immune suppression be reversed? ORL J Otorhinolaryngol Relat Spec 66:332-340, 2004.
[16] Galon J, Costes A, Sanchez-Cabo F, et al: Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science 313:1960-1964, 2006.
[17] Ferris RL, Blumenschein Jr G, Fayette J, et al. Nivolumab for recurrent squamous-cell carcinoma of the head and neck[J]. New England Journal of Medicine, 2016, 375(19): 1856-1867.
[18] Ferris RL, Blumenschein Jr G, Fayette J, et al. Nivolumab vs investigator’s choice in recurrent or metastatic squamous cell carcinoma of the head and neck: 2-year long-term survival update of CheckMate 141 with analyses by tumor PD- L1 expression[J]. Oral oncology, 2018, 81: 45-51.
[19] https://clinicaltrials.gov/ct2/show/NCT02741570
[20] Demaria S, Kawashima N, Yang AM, et al: Immune-mediated inhibition of metastases after treatment with local radiation and CTLA-4 blockade in a mouse model of breast cancer. Clin Cancer Res 11:728-734, 2005
[21] Karam SD, Raben D. Radioimmunotherapy for the treatment of head and neck cancer[J]. The Lancet Oncology, 2019, 20(8): e404-e416.