中國藥監局突然出手!萬億級外泌體市場一夜變天
2025年06月24日 23:39 湖北
中國國家藥監局出手!外泌體正式納入“先進治療藥品“監管!
從2025年6月10日,國家藥監局藥品審評中心(CDE)發佈《先進治療藥品的範圍、歸類和釋義(徵求意見稿)》到現在,這一顆外泌體行業重磅炸彈的熱度還在持續,對國內外泌體行業的影響無疑是非常巨大的。在這一歷史性時刻,也發表一下個人看法:
當然,這份檔不僅首次明確了ATMPs的監管標準,更關鍵的是,外泌體這個明星賽道終於有了官方身份證!
這意味著,外泌體產品正式告別灰色地帶,從化妝品、醫療器械的模糊監管,直接升級到和創新藥同等級別的先進治療藥品(ATMP)監管框架。
外泌體監管的三大歷史性突破
- 身份大升級:從美容概念到嚴肅藥品
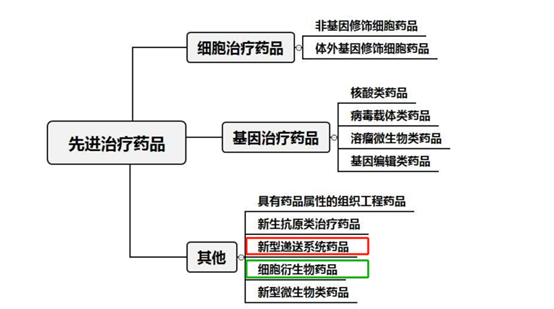
CDE這次直接採用國際通用術語——細胞外囊泡(EVs),並將其歸類為:
✅ 細胞衍生物藥品
✅ 新型遞送系統
和幹細胞治療、基因編輯藥物平起平坐,徹底甩掉了化妝品、醫美材料的帽子!
劃重點:以後想拿外泌體當抗衰神藥忽悠消費者?藥監局第一個不答應!
- 天然和基因工程外泌體各尤其歸屬
明確將外泌體分為兩類:天然來源(如幹細胞分泌的外泌體)和 基因工程修飾(比如裝載了抗癌RNA的工程化外泌體)。這意味著什麼?
意味著現有技術(比如MSC外泌體治療糖尿病足)有了明確路徑;未來更複雜的外泌體載藥技術(比如靶向腫瘤的工程化EVs)也有了監管依據。
- 監管對標國際:築起藥品級高牆
外泌體被納入ATMP監管,相當於在高速發展的行業裡立起了GMP(藥品生產品質管制規範)的大旗。
對外泌體行業有哪些影響?
- 小作坊式生產,將被淘汰;
- 低品質產品,也將“OUT”!
- 唯有真正有技術的企業,終將迎來屬於他們的“黃金時代”!
💥外泌體行業將迎來三大巨變
- 研發門檻大幅提高
以前:搞點細胞培養液,超速離心一下就能賣。
現在:必須符合藥品級生產標準(cGMP),工藝、質控、臨床資料一個都不能少。
- 資本流向頭部企業
沒有技術儲備的公司:融資難度飆升。
已佈局GMP生產的企業:估值可能翻倍。
- 臨床應用加速落地
糖尿病足潰瘍、骨關節炎等適應症的外泌體療法,有望成為首批獲批產品。
醫美亂象終結:”外泌體面膜”、”外泌體水光針”等誇大宣傳將受嚴打。
🚀未來預測:誰會成為贏家?
- 已佈局GMP生產的藥企
- 專注工程化外泌體的Biotech公司
- CRO/CDMO企業(外泌體藥物研發外包需求暴增)
📢行業建議:抓緊做這3件事!
- 調整策略:如果還在做低端外泌體提取,趕緊轉型!
- 關注臨床:優先佈局糖尿病足、神經修復、腫瘤免疫等明確賽道。
中國關於外泌體分類界定的歷史
- 外泌體不作為醫療器械管理
2. 外泌體不作為化妝品原料管理

3. 外泌體作為治療產品(藥品)

國際關於外泌體的分類界定
外泌體藥物監管風暴來襲!全球藥監機構如何應對?

一篇臺北醫科大學科學家團隊發表在《Clinical and Translational Science》的綜述文章《外泌體作為生物藥物的監管挑戰》,首次系統梳理了全球外泌體藥物開發的監管困局與技術突破,直指外泌體產業的核心矛盾“療效驚豔,但監管空白”。
外泌體為何會引爆醫療革命?
外泌體是細胞分泌的30-150納米的天然囊泡,攜帶蛋白質、RNA等活性物質,具有四大顛覆性優勢:
- 精准投遞:可穿透血腦屏障,靶向病變組織。
- 安全無免疫排斥:比干細胞治療更可控。
- 口服存活:突破生物製劑只能注射的限制。
- 凍幹保存:大幅降低運輸成本。
💡案例:間充質幹細胞(MSC)外泌體已在慢性腎病、關節炎、COVID-19等臨床研究中展現療效,韓國更將其廣泛應用於醫美領域!
⚠️監管雷區:為什麼FDA至今未批准任何外泌體藥物?
- 生產一致性難題
- 同細胞不同命:培養溫度、培養基成分的微小差異會導致外泌體功能顯著不同。
- 凍融損傷:液氮凍存後活性是否變化尚無標準驗證方法。
- 品質控制困境
- 現有技術局限:HPLC/GC-MS無法檢測外泌體,只能依賴電鏡、動態光散射等間接手段。
- 效力評估缺失:目前僅能監控粒徑和數量,無法確保療效。
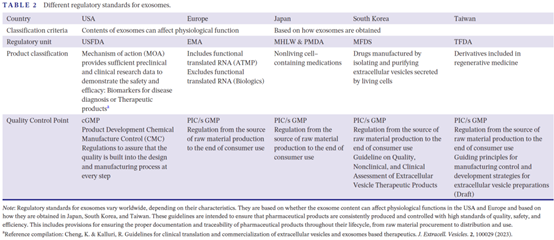
- 全球監管分裂
| 國家/地區 | 分類標準 | 監管機構 | 品質控制點 |
| 美國 | 按生理功能影響分類 | FDA-CBER | 需符合cGMP,強調生產程序控制(類似生物藥) |
| 歐盟 | 含功能RNA(基因治療藥物) | EMA-CAT | 執行PIC/S GMP,要求從原料到終端全鏈條追溯 |
| 日本 | 按製備方式分類 | PMDA | 非活細胞製劑按普通藥物管理 |
| 韓國 | 活細胞分泌物(生物藥) | MFDS | 發佈全球首個《外泌體治療產品評估指南》 |
| 臺灣 | 納入再生醫學衍生品 | TFDA | 參考PIC/S GMP,2023年發佈外泌體製劑開發草案 |
歐美以功能論監管,亞洲以來源定性質,這種分裂導致企業全球申報策略複雜化!
如何破局
三大技術革命正在改寫規則
- 工程化改造:通過基因編輯親代細胞,定制攜帶治療性RNA的外泌體。
- 凍幹/液體保護技術:添加海藻糖等保護劑,凍幹或液體劑型延長保質期至2年以上。
- 精細純化:將外泌體純度從70%提升至99%,滿足GMP要求。
台灣要持續領先有賴政府英名果斷 給業界一條生路
