國內外泌體領域進展總結(2025年2月)
中性粒細胞衍生的囊泡抑制補體啟動發揮抗炎作用
Hsu, A. Y., et al. (2025). “Neutrophil-derived vesicles control complement activation to facilitate inflammation resolution.”
Cell. IF=45.6
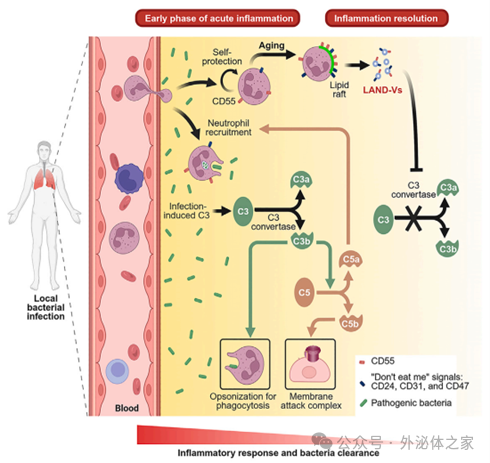
前期報導:【Cell】中性粒細胞衍生的囊泡抑制補體啟動發揮抗炎作用
腫瘤免疫中的細胞外囊泡
Kuang, L., et al. (2025). “Extracellular vesicles in tumor immunity: mechanisms and novel insights.”
Mol Cancer 24(1): 45.IF=27.7
細胞外囊泡在腫瘤發展和免疫逃逸機制中表現出雙重作用。EVs 可以通過削弱免疫細胞功能或調控免疫抑制通路,説明腫瘤細胞逃避免疫監視和攻擊,從而促進腫瘤的進展和轉移。相反,EVs 也可以運輸和釋放免疫調節因數,刺激免疫系統的啟動和調控,增強機體對抗惡性疾病的能力。EVs 的這種雙重功能為腫瘤免疫治療提供了有前景的方向和靶點。通過研究 EVs 的生物學特性及其對腫瘤免疫的影響,可以開發出新的治療策略,以提高癌症治療的效果和相關性。本綜述闡明了 EVs 在腫瘤免疫調節中的複雜作用,並探討了其在癌症治療中的潛在應用,旨在為未來基於EVs 的癌症免疫治療策略的進步奠定理論基礎並提供實踐見解。
炎症觸發的Gli1(+)幹細胞通過細胞外囊泡啟動異常中性粒細胞,加劇牙周免疫病理學
Cai, X. Y., et al. (2025). “Inflammation-triggeredGli1(+) stem cells engage with extracellular vesicles to prime aberrant neutrophils to exacerbate periodontal immunopathology.”
Cell Mol Immunol. IF=21.8
牙周炎是一種常見且逐漸惡化的疾病,其特徵是慢性炎症,其免疫病理機制尚未完全闡明。間充質幹細胞(Mesenchymal Stem Cells, MSCs)作為免疫調節因數,在維持組織穩態和再生中起著關鍵作用,但它們在免疫病理學和牙周組織退化中的體內功能仍不清楚。該研究利用多種轉基因小鼠模型,特異性標記、消融和調控Gli1(+)細胞(牙周組織中一類關鍵且具有代表性的MSCs亞群),以探討其在牙周免疫病理學中的具體作用。研究表明,Gli1(+)細胞在炎症微環境的挑戰下,可顯著誘導中性粒細胞的快速遷移和異常啟動,從而加劇牙槽骨的破壞。在機制上,Gli1(+)細胞釋放的細胞外囊泡(Extracellular Vesicles, EVs)作為牙周組織中的關鍵免疫調節因數,通過增強中性粒細胞活性氧(ROS)的生成以及刺激核因數κB(NF-κB)信號通路,介導了中性粒細胞的募集和啟動。此外,炎症刺激下Gli1(+)細胞來源的EVs表面暴露了CXC基序趨化因數配體1(CXCL1),通過CXCL1-CXC基序趨化因數受體2(CXCR2)軸啟動異常的中性粒細胞。重要的是,特異性抑制Gli1(+)細胞的EV釋放或使用GANT61進行藥物治療,可以改善牙周炎症和牙槽骨喪失。總之,該研究發現了Gli1(+)細胞在炎症條件下調控中性粒細胞浸潤和促進其異常啟動的全新作用,這為牙周炎的病理機制提供了新的見解,並提出了潛在的治療靶點。
修復肌腱病中的肌腱微環境——通過可注射肌腱水凝膠和肌腱來源幹細胞外泌體實現巨噬細胞調節和肌腱再生
Li, D., et al. (2025). “Restoring tendon microenvironment in tendinopathy: Macrophage modulation and tendon regeneration with injectable tendon hydrogel and tendon-derived stem cells exosomes.”
Bioact Mater 47: 152-169.IF=18
肌腱病是一種常見的肌肉骨骼疾病,其中相當一部分患者無法獲得有效的治療效果。炎症反應的程度以及膠原合成代謝的動態變化是影響肌腱內在自我修復能力的關鍵因素。然而,肌腱內的微環境較差,顯著阻礙了肌腱病的自我修復過程。該研究使用了一種可注射的肌腱來源去細胞外基質(tendon-derived decellularized extracellular matrix, tdECM)水凝膠來治療肌腱病。與膠原水凝膠相比,這種水凝膠提供了更具細胞相容性的微環境,同時保留了原生肌腱細胞外基質(ECM)的某些生物活性因數。值得注意的是,本研究首次發現tdECM水凝膠能夠促進M2型巨噬細胞的極化,從而在體內發揮抗炎作用。此外,將tdECM用作肌腱來源幹細胞外泌體(TDSCs-Exos)持續釋放的載體,通過體內和體外研究發現,tdECM水凝膠與外泌體結合後,在調節炎症、促進M2型巨噬細胞極化以及增強肌腱再生和修復效果方面表現出顯著的協同作用。這些結果表明,其作為一種治療肌腱疾病的潛在策略具有良好的應用前景。
全集成離心微流控技術用於快速外泌體分離、糖鏈分析和即時診斷
Zhao, X., et al. (2025). “Fully Integrated Centrifugal Microfluidics for Rapid Exosome Isolation, Glycan Analysis, and Point-of-Care Diagnosis.”
ACS Nano.IF=15.8
循環系統中的外泌體在疾病的診斷和治療方面展現出相當大的潛力。然而,血液樣本的複雜性質和高度豐富的蛋白質的存在對快速有效地從血液中分離和功能評估外泌體構成了重大障礙。該研究介紹了一種配備兩個納米篩檢程式的全集成光碟實驗室設備,稱為iExoDisc,它能夠在45分鐘內自動從400微升的血液樣本中分離外泌體。通過整合血漿分離模組、高豐度蛋白去除模組和基於納米孔膜的總分離模組,所獲得的外泌體純度顯著提高(約3-6倍),與傳統的超速離心和聚合物沉澱方法相比。此外,成功地利用MALDI-TOF-MS和含有56種凝集素的凝集素微陣列,對來自臨床三陰性乳腺癌(TNBC)患者的外泌體進行了非靶向和靶向糖鏈分析。兩種方法的結果均表明,半乳糖基化和唾液酸化可能作為TNBC的診斷指標。最後,通過利用外泌體特異性糖基化蛋白CD63作為概念驗證,成功實現了在2小時內集成即時晶片上的外泌體分離和原位檢測。因此,iExoDisc為早期癌症檢測、液體活檢和即時診斷提供了一種潛在的方法。
抗電場氣泡增強的無需清洗細胞外囊泡表面標誌物分析
Zhang, Y., et al. (2025). “Electric Field-Resistant Bubble-Enhanced Wash-Free Profiling of Extracellular Vesicle Surface Markers.”
ACS Nano. IF=15.8
對迴圈中的細胞外囊泡(EVs)進行高效分析有助於無創癌症診斷和治療監測,但由於繁瑣的分離、多步驟清洗以及靈敏度較低的技術限制,實際應用受到阻礙。該研究報導了一種多功能氣泡技術,可實現自分離、無需清洗、單步驟且超靈敏的EV表面標誌物分析,用於肺癌的早期診斷和治療監測。在該檢測中,浮力主導的氣泡具有抗電場特性,能夠實現EV回應的電活性探針釋放,通過電流體動力納米剪切力增強雜交,自分離出電極介面以最小化電化學測量中的雜訊,並實現單步驟、無需清洗的EV分析。該檢測的靈敏度接近單個EV水準,對非靶向EV表現出高度特異性,並可追蹤藥物誘導的EV表型變化。進一步研究表明,該技術能夠以超過95%的準確率區分癌症患者與非癌症對照組的血漿樣本(n = 111),通過機器學習實現準確的早期診斷,並以高於常規臨床血清標誌物的準確性監測術前/術後療效。這種基於氣泡驅動的單步驟EV檢測提供了一種有前景的、無需清洗的定量工具,可用於臨床精准液體活檢。
外泌體中低水準的miR-224-5p通過上調S100A4導致結直腸癌對5-FU的耐藥性
Yan, Y. Y., et al. (2025). “Low miR-224-5p in exosomes confers colorectal cancer 5-FU resistance by upregulating S100A4.”
Drug Resist Updat 79: 101211. IF=15.8
本研究旨在探討結直腸癌(CRC)仲介導5-氟尿嘧啶(5-FU)耐藥的分子標誌物。結果發現,5-FU耐藥CRC細胞來源的外泌體可增強HCT-15細胞的耐藥性和惡性特性。雙重篩選顯示,miR-224-5p在5-FU耐藥型中顯著下調,與S100A4蛋白上調相關。miR-224-5p直接靶向S100A4,其下調促進耐藥性和惡性特性,而上調可逆轉這些效應。此外,5-FU聯合維拉帕米通過調控miR-224-5p/S100A4通路逆轉耐藥性,雷公藤內酯通過該通路抑制惡性特性。miR-224-5p可作為預測和干預5-FU耐藥的分子標誌,雷公藤內酯或5-FU聯合鈣拮抗劑可作為耐藥患者的潛在治療策略。
四面體DNA納米結構修飾的工程化細胞外囊泡通過靶向GPX4增強口腔鱗狀細胞癌的治療效果
Wang, D., et al. (2025). “Tetrahedral-DNA-Nanostructure-Modified Engineered Extracellular Vesicles Enhance Oral Squamous Cell Carcinomas Therapy by Targeting GPX4.”
ACS Nano. IF=15.8
口腔鱗狀細胞癌(OSCC)是一種起源於口腔黏膜的異質性惡性腫瘤,目前主要治療方式包括手術、化療和放療,但5年生存率僅約50%。細胞外囊泡(EVs)作為藥物遞送平臺具有選擇性遞送小分子、核酸和蛋白質的潛力,而四面體DNA納米結構(TDNs)可促進藥物內吞和組織穿透。本研究通過將TDNs修飾於M1-EVs膜表面構建TDN@EVs,顯著提高了其生物穩定性和藥物遞送效率。體內外實驗表明,TDN@EVs抑制OSCC細胞增殖和遷移,促進凋亡,並具有優異的藥物穿透性。蛋白質組學分析發現Hsc70是其抗腫瘤活性的關鍵蛋白,通過TDN@EVs高效遞送至腫瘤細胞後,誘導GPX4降解,引發鐵死亡、線粒體應激和DNA損傷。TDN@EVs為OSCC治療提供了一種高效、安全的靶向遞送策略,展現出顯著的抗腫瘤效果和應用前景。
來源於微藻的細胞外囊泡與草本水凝膠協同作用,用於骨關節炎治療中的能量穩態調節
Liang, F., et al. (2025). “Microalgae-Derived Extracellular Vesicles Synergize with Herbal Hydrogel for Energy Homeostasis in Osteoarthritis Treatment.”
ACS Nano. IF=15.8
骨關節炎(OA)的治療因其複雜的病理微環境而具有挑戰性,該環境涉及活性氧、慢性炎症、線粒體功能障礙、能量缺乏和軟骨退化。本研究報導了從光合微生物螺旋藻中提取的細胞外囊泡(SP-EVs),其含有抗氧化和ATP依賴的活性及代謝相關化合物,用於OA治療。SP-EVs能有效遞送至軟骨細胞,調節細胞通訊和能量穩態。為了持續遞送SP-EVs,使用了大黃素水凝膠系統進行關節腔注射(Rh Gel@SP-EVs),在微酸性條件下表現出pH回應性和協同抗炎效果。Rh Gel@SP-EVs通過改善炎症介導的氧化應激和恢復線粒體膜電位,顯著改善了線粒體功能,促進ATP水準補充,平衡軟骨基質內的合成和分解過程,減緩OA進展。該策略利用基於微藻的草本水凝膠系統調節SP-EVs的持續釋放,通過調節能量代謝和抗炎機制,為OA治療提供了有效方法。
靜態拓撲線索結合動態流體刺激增強巨噬細胞外囊泡的產量及其在骨缺損治療中的潛力
Huang, H., et al. (2025). “Static Topographical Cue Combined with Dynamic Fluid Stimulation Enhances the Macrophage Extracellular Vesicle Yield and Therapeutic Potential for Bone Defects.”
ACS Nano. IF=15.8
該研究表明,結合靜態拓撲線索和動態流體刺激的3D列印灌注生物反應器可將巨噬細胞外囊泡(EVs)產量提高12.5倍,並通過上調miR-210-3p顯著增強其促進成骨分化和血管生成的生物活性,為EVs在骨缺損治療中的臨床轉化提供了一種可擴展、成本效益高且穩定的平臺。
表面雙樹枝狀磁性微纖維用於從微升級生物液體中快速分離細胞外囊泡並進行蛋白質組學分析
Chang, W., et al. (2025). “Surface Double Dendritic Magnetic Microfibrils for Rapid Isolation and Proteomic Profiling of Extracellular Vesicles from Microliters of Biofluids.”
ACS Nano. IF=15.8
該研究開發了功能化雙樹枝狀磁性微纖維(fDDMMs),用於從微升級生物液體中高效分離和蛋白質組學分析細胞外囊泡(EVs)。fDDMMs通過其多功能特性,實現了從1微升血漿樣本和100微升腫瘤類器官培養基中快速分離EVs和製備蛋白質組學樣本,為液體活檢和個性化醫學提供了巨大潛力。
利用點擊化學技術工程化的小型細胞外囊泡表達嵌合抗原受體,在急性肝功能衰竭中表現出增強的療效
Lu, Y. T., et al. (2025). “Small Extracellular Vesicles Engineered Using Click Chemistry to Express Chimeric Antigen Receptors Show Enhanced Efficacy in Acute Liver Failure.”
J Extracell Vesicles 14(2): e70044. IF=15.5
對乙醯氨基酚(APAP)過量可能導致嚴重的肝損傷和威脅生命的狀況,若未及時治療,可能引發多器官衰竭。N-乙醯半胱氨酸(NAC)是公認的用於APAP過量解毒的治療方法。然而,在急性肝衰竭(ALF)中,尤其是攝入量較大的情況下,NAC可能無法完全恢復肝功能。此外,NAC在ALF治療中存在局限性,並可能引發噁心、嘔吐、腹瀉、脹氣、胃食管反流和類過敏反應等不良反應。基於間充質基質細胞(MSC)旁分泌活性的療法在治療ALF方面展現出希望,已有臨床前研究表明其可改善病情。近年來,來源於MSC的細胞外囊泡(EVs)作為一種治療肝損傷的新選擇逐漸受到關注。MSC來源的EVs可根據來源細胞攜帶多種治療性貨物,參與生理過程並對異常情況作出回應。然而,大多數治療性EVs在進入體內後缺乏明確的方向性,導致靶向特異性不足。因此,迫切需要提高天然EV遞送系統的精准性。為此,該研究開發了一種先進的靶向技術,用於在體內遞送改良的EVs。該策略是利用生物正交點擊化學技術,將靶向分子附著到小型細胞外囊泡(sEVs)的表面,生成外源性嵌合抗原受體修飾的sEVs(CAR-sEVs)用於治療。首先,通過代謝糖工程技術,我們通過用含疊氮基的單糖N-疊氮乙醯甘露糖胺(Ac4ManNAz)處理MSC,製備了疊氮修飾的sEVs(N3-sEVs)。接著,將N3-sEVs與二苯並環辛炔(DBCO)標記的單鏈可變片段(DBCO-scFv)偶聯,該片段靶向去唾液糖蛋白受體(ASGR1),從而生成CAR-sEVs,實現對肝臟的精准靶向。通過靶向ASGR1驗證了CAR-sEV療法在ALF模型中的療效。MSC來源的CAR-sEVs降低了血清肝酶水準,減輕了肝損傷,並促進了APAP誘導損傷中的肝細胞增殖。總體而言,CAR-sEVs展現出增強的肝細胞特異性和治療肝損傷的療效,突顯了細胞外靶向療法的顯著進展。
由肝細胞癌中基質剛度調控的外泌體miRNAs觸發的葡萄糖富集型肺部轉移前微環境
Zhao, Y., et al. (2025). “A glucose-enriched lung pre-metastatic niche triggered by matrix stiffness-tuned exosomal miRNAs in hepatocellular carcinoma.”
Nat Commun 16(1): 1736. IF=14.7
除了經典特徵外,在肝細胞癌(HCC)轉移前微環境形成過程中是否存在其他新的病理特徵幾乎未知。之前的研究強調了基質剛度增加對HCC中肺部轉移前微環境形成和轉移的貢獻。然而,基質剛度增加是否影響肺部轉移前微環境的葡萄糖代謝和供應仍然很不清楚。該研究揭示了基質剛度調控的外泌體miRNAs作為主要貢獻者,通過減少肺成纖維細胞的葡萄糖攝取和消耗,同時增加血管生成和血管通透性,從而在肺部轉移前微環境形成過程中調節葡萄糖富集的潛在機制。研究表明,葡萄糖富集是由基質剛度調控的外泌體miRNAs觸發的肺部轉移前微環境的新特徵,對於轉移腫瘤細胞的定植、生存以及後續轉移灶的生長至關重要。
利用來源於再生新生兒心臟組織的細胞外囊泡進行心臟修復
Li, H., et al. (2025). “Cardiac repair using regenerating neonatal heart tissue-derived extracellular vesicles.”
Nat Commun 16(1): 1292.IF=14.7
新生哺乳動物的心臟在受損後能夠通過誘導心肌細胞增殖實現再生。然而,這種再生能力在成年哺乳動物心臟中幾乎消失。研究表明,細胞外囊泡(EVs)在心臟修復中發揮重要的心臟保護作用。本文報導,從再生的新生兒心臟組織中提取的細胞外囊泡(AR-Neo-EVs)在心尖切除手術後表現出比新生鼠心臟組織提取的細胞外囊泡(Neo-EVs)更強的促增殖、抗凋亡和促血管生成活性,而這些效果在成年鼠心臟來源的細胞外囊泡(Adu-EVs)中不存在。蛋白質組學分析顯示,AR-Neo-EVs中Wdr75蛋白(一種p53調節因數)的表達高於Neo-EVs。當Wdr75被敲低時,AR-Neo-EVs的再生潛力被削弱。研究進一步表明,通過海藻酸鈉水凝膠微球遞送AR-Neo-EVs是治療心肌梗死的有效方法。該研究展示了利用再生組織來源的細胞外囊泡觸發保護和再生機制的潛力。
HBV相關的肝細胞癌通過長鏈非編碼RNA HDAC2-AS2抑制抗腫瘤CD8(+) T細胞
Gao, Y., et al. (2025). “HBV-associated hepatocellular carcinomas inhibit antitumor CD8(+) T cell via the long noncoding RNA HDAC2-AS2.”
Nat Commun 16(1): 2055. IF=14.7
該研究發現HBV相關肝細胞癌通過腫瘤細胞分泌的細胞外囊泡攜帶的長鏈非編碼RNA HDAC2-AS2抑制腫瘤內CD8(+) T細胞的細胞毒性,從而促進腫瘤進展,並提出HDAC2-AS2可作為肝細胞癌的潛在生物標誌物和治療靶點。
胎盤通過外泌體中的PPARγ調控子宮內胎兒的生長
Luo, X., et al. (2025). “The Placenta Regulates Intrauterine Fetal Growth via Exosomal PPARγ.”
Adv Sci (Weinh): e2404983. IF=14.3
腫瘤細胞來源的細胞外囊泡對免疫逃逸的影響
Liu, X., et al. (2025). “Effect of Extracellular Vesicles Derived From Tumor Cells on Immune Evasion.”
Adv Sci (Weinh): e2417357. IF=14.3
