誘導多能幹細胞來源NK細胞腫瘤免疫治療取得新進展
導讀:NK細胞的細胞毒性在很大程度上取決於IgG Fc受體CD16a,其介導抗體依賴性細胞介導的細胞毒性(ADCC)。高親和力和不可切割的CD16(hnCD16)被開發並顯示出多腫瘤殺傷潛力。然而,hnCD16受體啟動單個CD16信號並提供有限的腫瘤抑制。如何利用hnCD16的特性並摻入NK細胞特異性活化結構域是進一步提高NK細胞抗腫瘤活性的有前景的發展方向。
6月14日,北京大學基礎醫學院李揚副教授和北京大學人民醫院趙翔宇教授合作在《Journal of Hematology&Oncology》雜誌線上發表題為“Leveraging CD16 Fusion Receptors to Remodel the Immune Response for Enhancing Anti-Tumor Immunotherapy in iPSC-Derived NK Cells”的研究論文,揭示了該融合受體通過重塑免疫應答以增強NK細胞抗腫瘤功能的機制,並將hnCD16FR在誘導多能幹細胞來源NK細胞(hnCD16FR-iPSC-NK)中進行工程化修飾,證明瞭hnCD16FR-iPSC-NK細胞具有良好的應用前景,可以為以NK細胞為基礎的抗腫瘤免疫療法提供新的策略和選擇。
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10265820/
研究背景
使用工程免疫效應細胞的過繼細胞療法已成為治療血液學和實體惡性腫瘤的一種很有前途的新方法。在幾種免疫效應物的選擇中,自然殺傷(NK)細胞被證明在對惡性細胞和病毒感染的先天免疫應答中起關鍵作用。特別是嵌合抗原受體(CAR)工程的NK細胞由於其獨特的生物學特性而最近引起了相當大的關注 。與T細胞不同,NK細胞缺乏表面T細胞受體(TCR),不會引起移植物抗宿主病(GvHD),這是同種異體NK細胞療法的關鍵優勢,可實現工程化NK細胞的規模化製造和現成給藥用於癌症免疫治療。評估同種異體NK細胞過繼轉移的臨床試驗表明,這種療法是安全的,幾乎沒有證據表明細胞因數釋放綜合征(CRS)或神經毒性等毒性。此外,自體CAR-T細胞治療在移植後可以持續多年,而同種異體NK細胞通常在宿主中存活的時間較短。同種異體NK細胞的這種特性可能有助於更準確的給藥策略,允許多次組合給藥,並避免長期累積毒性,這在接受CAR-T治療的患者中很常見。
用於癌症免疫治療的NK細胞的來源多種多樣,即外周血來源的NK(PB-NK)細胞,臍帶血分離NK(UCB-NK)細胞和NK細胞系。PB-NK和UCB-NK過繼細胞療法在治療各種血液系統癌症方面取得了許多成功。然而,PB-NK細胞和UCB-NK細胞的NK細胞產量和亞群組成對供體的依賴性極強,因為這些細胞通常不是來自單一的可再生資源,使得產品標準化和多劑量策略變得困難。此外,原代NK細胞的遺傳修飾效率低,但變化很大,這使得難以利用一致且可重複的工程NK細胞療法。
研究進展
在我們的初步研究中篩選了三種不同的融合受體構建體,並測試了它們對NK細胞功能的啟動作用。所有融合受體均基於CD16a變體設計,可增加FcγRIIIa對抗體Fc片段(F158V)的親和力並抵抗ADAM17介導的切割(S197P),並針對增強NK細胞的活性進行了優化。我們設計了NK細胞特異性hnCD16融合受體構建體,其由信號肽,hnCD16的細胞外和跨膜結構域,通常在NK細胞中表達的細胞內1或2共刺激結構域(CD)以及刺激結構域(SD)CD3ζ或FcεRIγ組成。CD16a的細胞質尾部沒有任何ITAM結構域,因此需要含有ITAM結構域CD3ζ和FcεRIγ的細胞內鏈串聯的幫助,它們都與CD16a相關。
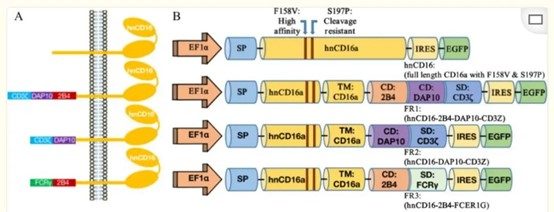
為了驗證hnCD16FR與不同的治療性mAb聯合使用可以有效殺死表達不同腫瘤相關抗原的癌細胞,我們使用表達三種hnCD16FR構建體中每種的NK細胞對肺癌細胞系A549進行了ADCC測定。與殺死Raji細胞的結果類似,FR1(hnCD16-2B4-DAP10-CD3ζ)構建體對A549細胞的ADCC作用優於其他構建體。FR2(hnCD16-DAP10-CD3ζ)和FR3(hnCD16-2B4-FcεRIγ) 構建介導的與hnCD16構建體相當的A549細胞殺傷。
我們的資料表明,與先前報導的hnCD16構建體相比,hnCD16與2B4-DAP10-CD3ζ的組合融合促進了ADCC功能的啟動,以增強抗體誘導的NK細胞介導的抗原依賴性抗腫瘤細胞毒性。
研究結果
在本研究中,我們篩選了殺死B細胞淋巴瘤的最有效組合,B細胞淋巴瘤與hnCD16a的外域,NK特異性共刺激劑(2B4和DAP10)和細胞質結構域中的CD3ζ融合在一起。篩選的構建體在NK細胞系和iNK細胞中顯示出優異的細胞毒性作用和敏銳的多種細胞因數釋放。hnCD16-和hnCD16FR轉導NK細胞的轉錄組學分析和驗證結果顯示,hnCD16FR轉導重塑了NK細胞中的免疫相關轉錄組,其中與hnCD16轉導相比,強調了與細胞毒性、高細胞因數釋放、誘導腫瘤細胞凋亡和ADCC相關的基因的顯著上調。體內異種移植研究表明,工程化hnCD16FR iPSC來源的NK細胞的單一低劑量方案與抗CD20 mAb治療共同給藥可介導有效的活性並顯著提高存活率。
總之,我們開發了一種新型hnCD16FR構建體,其表現出比報導的hnCD16更有效的細胞毒性,這是一種有前途的治療惡性腫瘤的方法,具有改善的ADCC特性。我們還為NK啟動結構域提供了基本原理,該啟動域重塑免疫反應以增強NK細胞中的CD16信號傳導。
參考資料:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10265820/
2023年6月14日,北京大學基礎醫學院李揚副教授和北京大學人民醫院趙翔宇教授合作在Journal of Hematology & Oncology ((IF=23.168))雜誌線上發表題為“Leveraging CD16 Fusion Receptors to Remodel the Immune Response for Enhancing Anti-Tumor Immunotherapy in iPSC-Derived NK Cells”(利用CD16融合蛋白重塑免疫應答以增強iPSC衍生NK細胞抗腫瘤免疫療法)的研究成果。本研究開發了一種新型hnCD16融合受體(high-affinity non-cleavable CD16 fusion receptor,hnCD16FR),該融合受體由hnCD16的胞外域、NK細胞特異性共刺激因數(2B4和DAP10)和CD3ζ構成的胞內段,它在體外和體內實驗中均表現出顯著增強的抗體依賴性細胞毒性,並初步揭示了該融合受體通過重塑免疫應答以增強NK細胞抗腫瘤功能的機制,並將hnCD16FR在誘導多能幹細胞來源NK細胞(hnCD16FR-iPSC-NK)中進行工程化修飾,證明了hnCD16FR-iPSC-NK細胞具有良好的應用前景,可以為以NK細胞為基礎的抗腫瘤免疫療法提供新的策略和選擇。

近年來,由於NK細胞相比於T細胞具有更好的治療安全性,更多的受體啟動機制,同時可以允許生產現貨型的產品的特點,使得其在過繼性細胞治療領域取得了廣泛的關注。目前開發出以誘導多能幹細胞(induced pluripotent stem cell, iPSC)為基礎的NK細胞生產方法已經可以用於臨床級的規模化生產,並用於癌症的免疫治療。當前,免疫療法正處於從基礎研究向轉化醫學邁進的時代,這催生了許多創新性免疫治療策略,其中一種重要的治療手段是通過使用治療型抗體來誘導抗體依賴性細胞介導的細胞毒性(ADCC)來靶向腫瘤並啟動NK細胞功能。
NK細胞的ADCC效應取決於在其膜表面表達的IgG受體CD16。最近的研究中開發了具有高親和力和不可剪切特性的CD16(hnCD16),並證明了其具有對多種腫瘤的殺傷潛力。然而,hnCD16受體只能啟動單一的CD16信號並提供有限的腫瘤抑制效果。由此,設計一種可以利用抗體療法優勢,並且能夠靶向多種腫瘤抗原的基於hnCD16的融合信號受體,使其在保留多抗原靶向性特點的基礎上,可以同時擴展抗腫瘤信號啟動是進一步提高NK細胞抗腫瘤活性的一個有前景的發展方向。
在本研究中,首先利用NK細胞系在體外篩選出可以介導最有效ADCC抗腫瘤活性的融合受體結構,該融合受體由hnCD16的胞外域、NK細胞特異性共刺激因數(2B4和DAP10)和CD3ζ構成的胞內段組成(圖1)。
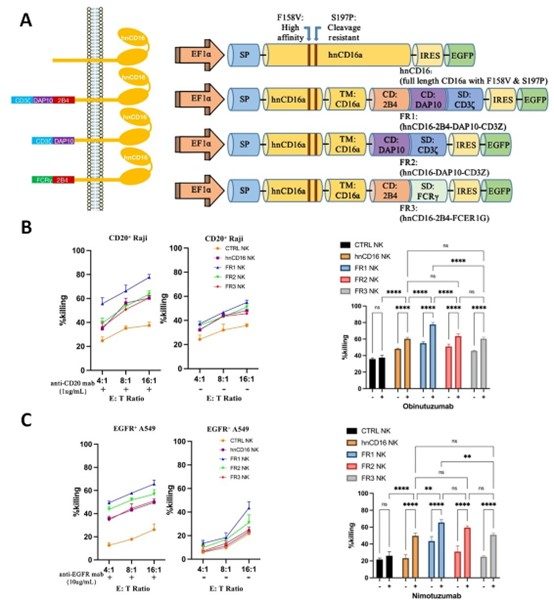
圖1. 融合受體結構示意圖與抗B細胞淋巴瘤、肺癌細胞殺傷效果
進一步通過轉錄組學分析表明,hnCD16FR的表達重塑了NK細胞中的免疫相關轉錄組,與hnCD16相比hnCD16FR工程化的NK細胞與細胞毒性、細胞因數產生、誘導腫瘤細胞凋亡和ADCC作用相關的基因都發生了顯著上調。細胞因數釋放實驗證實了hnCD16FR工程化可以 介導NK功能相關細胞因數的大量釋放(圖2)。

圖2. hnCD16FR重塑了NK細胞中的免疫相關轉錄組並介導NK功能相關細胞因數的大量釋放
將篩選出的hnCD16FR在 iPSC 中進行工程化修飾,並將其分化為hnCD16FR-iNK(induced NK)細胞進行腫瘤免疫細胞治療。與NK細胞系得到結果一致,與對照相比,hnCD16FR-iNK表現出顯著的細胞因數釋放和體外ADCC抗腫瘤活性(圖3)。

圖3. hnCD16FR-iPSC其衍生NK細胞的體外抗腫瘤活性
最後,在小鼠B細胞淋巴瘤異種移植動物模型中進一步驗證hnCD16FR-iPSC衍生NK細胞體內的ADCC抗腫瘤功能。研究結果顯示,工程化修飾的hnCD16FR-iPSC衍生NK細胞的單次、低劑量注射方案與抗CD20 mAb的聯合治療策略,可以有效介導ADCC抗腫瘤活性並顯著延長生存期(圖4)。

圖4:在腫瘤異種移植模型中hnCD16FR-iNK細胞聯合治療的抗腫瘤效果。
綜上所述,本研究設計並篩選了由NK細胞啟動結構域構成的hnCD16融合受體,並使用iPSC平臺在體外構建了均質表達hnCD16FR的iNK細胞,這些hnCD16FR-iNK細胞可以與治療型mAb聯用以觸發有效的ADCC效應並產生多種細胞因數以響應抗腫瘤免疫。同時這些經過hnCD16FR工程化的iNK細胞與抗體聯合使用可以在體內介導有效的腫瘤控制。這項研究將有助於擴展iPSC-NK細胞在腫瘤免疫治療領域的應用前景。
北京大學基礎醫學院碩士研究生孟繁一為該文章的第一作者,北京大學基礎醫學院李揚副教授、北京大學人民醫院趙翔宇教授、北京大學基礎醫學院周士新副教授為共同通訊作者。該研究得到國家重點研發計畫、國家自然科學基金、瑞臻再生醫學研究基金、北大醫學交叉研究種子基金的資助。
原文連結:https://jhoonline.biomedcentral.com/articles/10.1186/s13045-023-01455-z
