如果雙抗替代CAR-T,工程化細胞治療下一步去哪裡?(Science)
傳統免疫細胞療法(ICT)在實際應用上面臨的兩個關鍵挑戰在於成本高昂和製造複雜性。其它“通用型”可注射替代藥物(例如,雙抗治療血液惡性腫瘤)如果被證明具有同等效果,最終可能會取代ICT的使用。不過,免疫細胞通過工程改造能夠具有天然細胞中不存在的能力,例如改變和控制疾病微環境,這是傳統療法無法實現的。生產方面,已有自動化模組化的工藝能夠加快細胞治療的製備,以提高效率和降低成本。此外,使用工程化改造的“現貨”ICT或直接在體內工程化的ICT,已經熱度很高的研究領域,如果在未來獲得成功,可能會消除細胞療法當前的大部分問題。
近日,國際頂尖學術期刊 Science 發表了針對細胞工程的特刊。
針對CAR-T等工程化免疫細胞療法當前的局限性,題為:The future of engineered immune cell therapies 的特刊綜述,探討了細胞工程這一革命性技術未來將如何釋放更多的應用潛力來克服挑戰。

ICT正在基於T細胞、巨噬細胞、NK或DC等細胞進行開發,這些細胞來自患者自體,或來自“現貨”來源的細胞例如NK細胞系和iPSC。ICT領域當下發展迅猛,僅在clinicaltrials.gov上列出的“CAR-T細胞療法”臨床試驗就有1000多項。
挑戰與機遇
工程化T細胞療法在實體瘤中面臨著有效性的障礙,包括低效的腫瘤浸潤、抗原表達的異質性、功能持久性差、T細胞耗竭。多種免疫抑制機制已經確定,包括代謝抑制物質(腺苷)、檢查點分子(PD-L1)、抑制性轉化生長因數-β(TGF-β)、 IL-10等細胞因數,以及各種抑制性細胞類型(CAF、MDSC、Treg等)。

另外,ICT的毒性是一個特別令人擔憂的問題,尤其是在設計中努力放大免疫細胞的效應功能的情況下。 自體T細胞在安全性和長期移植潛力方面具有明顯的生物學優勢,但更“類藥”的通用型同種異體免疫細胞將更快地交付給患者,並降低製造成本。 如今基於不同細胞工程設計的新型細胞療法不斷出現,各路技術將有望逐漸解決當前的這些挑戰。 從細胞工程的角度來看,工程化改造技術在ICT的開發中發揮了三大關鍵作用 (圖1) :(i) 抗原受體工程,包括TCR、CAR;(ii) 宿主細胞基因組工程,針對細胞內信號通路的基因修飾,以調節細胞的代謝、生存和增殖等特性;(iii) 引入為免疫細胞提供新功能的輔助基因,包括加入治療性有效載荷,發揮協同作用。 這些設計可能會超過載體的DNA大小限制,需要基因遞送和製造方面的創新以確保其成功的臨床轉化。
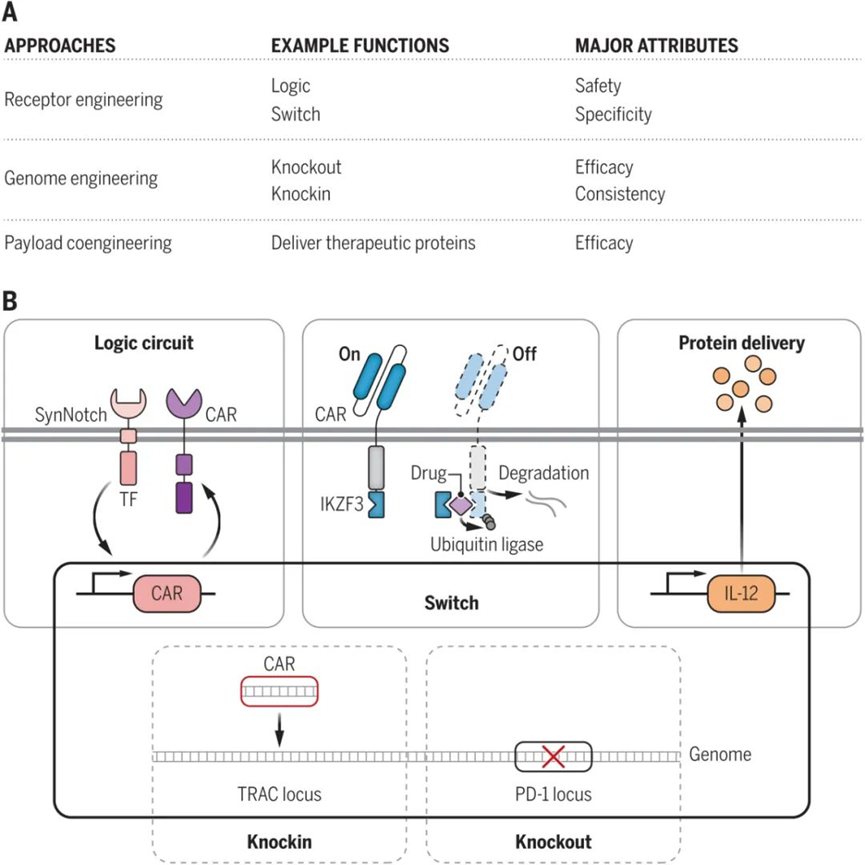
抗原受體工程
CAR是免疫細胞治療中研究最多的受體之一。 邏輯電路CAR可以感知多種抗原並執行組合邏輯運算,有效地區分健康細胞和癌細胞,從而最大限度地減少“脫靶”效應。邏輯電路CAR還可以感受組織微環境中的因素,以説明控制工程細胞在組織中的位置。目前已有研究實現了多達三個輸入的CAR改造。這些複雜的設計很難通過用於其他治療方式 (例如小分子或工程蛋白) ,因此突出了細胞療法的獨特潛力。 邏輯門控CAR能夠説明減少免疫逃逸所帶來的癌症復發,並且已經在實體瘤和血液瘤顯示出潛力,包括“或閘”CAR (與兩種不同靶抗原之一結合而觸發) 、“及閘”CAR (僅當兩種不同的靶抗原同時參與時才被啟動) 等。 CAR與TCR相比,CAR擁有不依賴于患者MHC的優勢;而與TCR相比,CAR往往具有較低的抗原敏感性。一些新興技術結合了CAR和TCR的優勢: T細胞受體融合結構 (TRuCs) 由靶向腫瘤相關抗原的特異性抗體融合到5個TCR亞基的胞外N-末端組成,顯示出與CAR相似的抗原敏感性,同時降低炎性細胞因數的產生。

合成 T 細胞受體抗原受體 (STARs) 將兩個抗體scFv分別融合到TCR的α鏈和β鏈,已在研究中表現出顯著的體內活性和抗原敏感性。

治療性有效載荷
除了表達抗原特異性受體外,工程化免疫細胞以表達治療有效載荷,可以幫助調節細胞功能。分泌治療性藥物的“裝甲”CAR,可以採用細胞因數 (例如 IL-12、IL-15) 、治療性抗體 (例如抗 PD-L1) 、重塑腫瘤微環境或啟動前藥的酶作為有效載荷。 另一種策略是設計“基因開關”來調整有效載荷生產的強度和時間,提高安全性。例如,已批准的抗癌藥物來那度胺,可以被用於開啟或關閉免疫細胞的抗腫瘤活性,優化ICT的毒副作用和療效。 基因組工程 CRISPR技術為通用 CAR-T 細胞打開了大門。利用CRISPR/Cas9系統同時破壞多個基因位元點產生TCR和HLA-I缺陷的CAR-T細胞,可以減少移植物抗宿主病 (GvHD) 和免疫排斥反應的發生。 除了基因敲除外,CRISPR–Cas9還可以通過HDR修復實現非病毒的CAR敲入 (例如Fate公司的FT819) 。相比於不可預測的NHEJ途徑,HDR介導的編輯可以在存在供體DNA範本的情況下,確保將基因精確插入特定基因座。該方法能夠幫助提高CAR-T細胞療法的穩健性,實現更均勻的CAR表達和增強的效力。
免疫細胞製造
ICT生產中最大的挑戰之一是使用病毒進行基因轉導,這是一個失敗率很高的複雜過程。為了克服這一挑戰,正在開發在原代人類免疫細胞中進行基因傳遞的非病毒方法,例如 mRNA 轉染或基於轉座子的基因組工程工具。 細胞來源的異質性是另一個挑戰,在使用患者來源的細胞時,患者的病史或疾病階段可導致T細胞功能障礙並改變免疫細胞組成,從而導致產生的免疫細胞產品品質不佳。 許多公司已經通過使用NK細胞或iPSC衍生的免疫細胞替代自體細胞,並結合基因組編輯工具,開發出了同種異體“現貨”細胞療法。然而,這些方法有其自身特定的挑戰。例如,NK細胞比T細胞更不容易被病毒轉導,而且基因組編輯也存在“脫靶”等問題。 工程免疫細胞療法已技術取得了長足進步,但尋找更安全、更有效的策略仍有巨大的探索空間。此外,業界正在不斷探索ICT在更多適應症中的應用,例如使用CAR-T來治療心力衰竭或其他纖維化疾病。 更重要的是,ICT不斷產生的人體試驗資料還為瞭解免疫系統在疾病中的功能提供了思路。譬如資料的不斷擴大可以説明發現介導疾病發生發展的新基因和新靶點,也可以説明電腦建模,以預測細胞療法和基於機器學習的資料分析中需要優化的關鍵參數。
參考資料 : https://www.science.org/doi/10.1126/science.abq6990
