靶向T細胞和NK細胞的協同作用
腫瘤異質性是包括免疫療法在內癌症治療方法面臨的主要挑戰之一。異質性可通過獲得新突變而產生,從而產生抗治療腫瘤亞克隆。此外,癌細胞可以通過改變其細胞狀態來適應治療壓力。因此,我們面臨的任務是如何積極設計免疫療法,防止耐藥腫瘤細胞的選擇。
T細胞和自然殺傷(NK)細胞在腫瘤免疫中具有互補作用,這些淋巴細胞群體使用不同的識別策略來識別癌細胞,NK細胞可以殺死逃脫CD8+T細胞識別的癌細胞。因此T細胞和NK細胞的雙重攻擊為加深免疫治療的影響提供了機會。最近的研究還表明,NK細胞在向腫瘤招募樹突狀細胞中發揮重要作用,從而增強CD8+T細胞應答的誘導,而T細胞分泌的IL-2啟動NK細胞。
有趣的是,T細胞和NK細胞還共用幾種重要的抑制和啟動受體,這些受體可以作為增強T細胞和NK-細胞免疫作用的靶點。這些抑制性受體配體系統包括CD161-CLEC2D、TIGIT-CD155和NKG2A/CD94-HLA-E。此外,基於抑制和啟動細胞因數的新的治療策略也可以發揮T細胞和NK細胞的協同作用,這些基於T細胞和NK細胞協同作用的療法將深刻影響目前的癌症免疫治療。
T細胞和NK細胞識別腫瘤細胞的分子邏輯
T細胞和NK細胞在腫瘤細胞識別的分子機制上有根本不同。T細胞通過TCR介導的MHC結合肽抗原識別腫瘤細胞。T細胞的所有關鍵功能都在TCR的控制下,包括細胞毒性、細胞因數產生和增殖。因此,腫瘤可以通過下調或丟失MHC-I表達逃避CD8+T細胞的作用。

相反,NK細胞利用一系列啟動和抑制受體來識別應激和轉化的細胞,如NKG2D、NKp46、NKp30和NKp44受體。與T細胞相比,NK細胞識別腫瘤細胞不依賴於任何唯一的啟動受體,這一事實為識別應激和轉化的細胞提供了更大的靈活性。因此,T細胞和NK細胞對腫瘤細胞施加不同的選擇壓力,為T細胞和NK細胞雙重靶向腫瘤提供了理論依據。
T細胞和NK細胞的共用受體
T細胞和NK細胞從生物學上經常被認為是適應性免疫識別和固有免疫識別的嚴格區分。然而,NK細胞和CD8+T細胞的受體-配體系統也存在大量重疊。因此,CD8+T細胞和NK細胞表達的活化和抑制受體提供了使它們參與協同抗腫瘤免疫的機會。
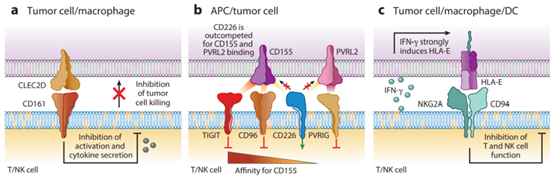
CD161及其配體CLEC2D
CD161受體屬於C型凝集素受體家族,並形成同源二聚體。它最初被鑒定為NK細胞上的一種抑制性受體,其阻斷對表達CLEC2D配體的腫瘤細胞的殺傷。最近,CD161也被確定為腫瘤浸潤T細胞的重要抑制受體。CLEC2D是一種C型凝集素受體,在幾種人類癌症的腫瘤細胞和浸潤性髓系細胞上表達。CLEC2D在生髮中心B細胞中高水準表達。因此,起源于生髮中心B細胞的B細胞淋巴瘤可以表達高水準的CLEC2D,包括濾泡性淋巴瘤、伯基特淋巴瘤和具有生髮中心B-細胞樣基因表達特徵的彌漫性大B細胞淋巴瘤亞型。在Toll樣受體(TLR)啟動後,DC和B細胞也表達CLEC2D。因此,靶向這種抑制性受體可以增強T細胞和NK細胞的抗腫瘤活性。
NKG2A/CD94及其配體HLA-E
HLA-E是一種非經典MHC Ib分子,與NK細胞和CD8+T細胞亞群表達的抑制性NKG2A/CD94受體結合。在許多實體瘤中,HLA-E在腫瘤細胞過表達,並且在腫瘤浸潤巨噬細胞和DC上也檢測到這種蛋白的表達。NKG2A/CD94受體由大多數迴圈和腫瘤浸潤的NK細胞組成性表達。雖然只有一小部分血液CD8+T細胞表達NKG2A/CD94,但其表達會在共表達PD-1和其他抑制性受體的腫瘤浸潤CD8+T細胞中上調。
CD226受體和抑制性對應受體TIGIT、CD96和PVRIG
CD226受體是NK細胞和CD8+T細胞表達的重要共刺激受體。這種啟動性受體的主要配體CD155在人類癌細胞中廣泛表達,此外,CD226還與第二配體PVRL2(CD112)結合。有趣的是,啟動CD226受體的活性被三種抑制性受體TIGIT、CD96和PVRIG拮抗。TIGIT和CD96抑制性受體對共有CD155配體的親和力高於CD226,並且可以在配體結合方面勝過CD226。在這三種抑制性受體中,TIGIT的研究最為廣泛。TIGIT由NK細胞、CD8+T細胞和調節性T細胞(Tregs)表達。TIGIT在不同實體瘤和淋巴瘤中的腫瘤浸潤CD8+T細胞高表達。TIGIT也是NK細胞中的一種重要抑制受體,並導致腫瘤中的NK細胞功能障礙。PD-1和TIGIT都抑制CD226,但通過不同的機制:PD-1在CD226的胞質結構域中去磷酸化Tyr-322,而TIGIT在CD155結合方面超過CD226。CD96和PVRIG受體的研究較少。在小鼠模型中,CD8+T細胞或NK細胞中CD96受體的失活增強了抗腫瘤免疫,但其在人類細胞中的作用尚不清楚。PVRIG也由T細胞和NK細胞表達,其主要配體是PVRL2。
NKG2D受體及其應激誘導配體
NKG2D受體由人NK細胞、CD8+T細胞和先天性T細胞(NKT細胞和γδT細胞)表達。啟動後,NKG2D通過銜接蛋白DAP10發出信號,誘導NK細胞、γδT細胞和NKT細胞的穿孔素依賴性細胞裂解;它還為CD8+T細胞提供共刺激信號。
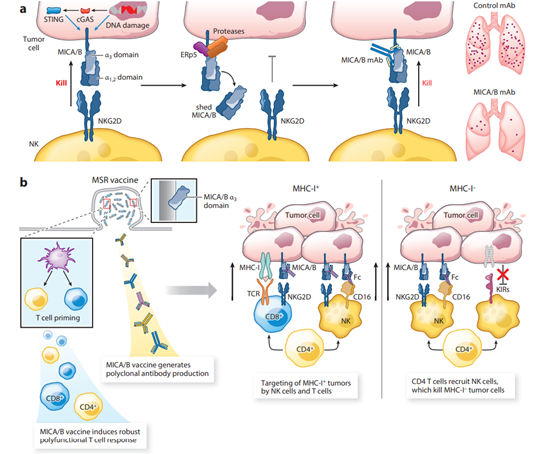
NKG2D受體識別一組受應激和轉化細胞上調的配體。在人類中,這些配體包括MICA/MICB和ULBP1-6蛋白;在小鼠中,這些配體包括Rae1α–ε、H60a–c和Mult1。這種受體-配體系統對腫瘤免疫很重要,因為這些配體被DNA損傷和cGAS STING信號上調,但很少被健康細胞表達。本質上,NKG2D配體的上調標誌著應激細胞被細胞毒性淋巴細胞清除。NKG2D配體的表達經常在多種實體瘤和血液瘤中檢測到,包括前列腺癌、卵巢癌和乳腺癌以及黑色素瘤和多發性骨髓瘤。
MICA/B的蛋白水解脫落通過顯著降低腫瘤細胞表面上這些刺激性NKG2D配體的密度而導致免疫逃逸。二硫異構酶ERp5參與脫落的啟動:它破壞MICA/Bα3結構域中的結構二硫鍵,使其可通過ADAM-10/17和MMP14進行蛋白水解。脫落MICA與許多人類癌症的疾病進展密切相關,但在健康受試者的血清中未檢測到。
NK細胞-DC細胞-T細胞軸
NK細胞不僅充當細胞毒性效應細胞,還可以將DC細胞招募到實體瘤中,從而形成T細胞介導的腫瘤免疫。傳統DC目前分為兩個主要子集,cDC1和cDC2。通過將凋亡腫瘤細胞的細胞相關抗原呈遞給CD8+和CD4+T細胞,cDC1亞群對保護性抗腫瘤免疫至關重要。除了這種傳遞作用外,cDC1還通過招募和啟動腫瘤特異性CD8+T細胞在腫瘤中發揮關鍵作用。
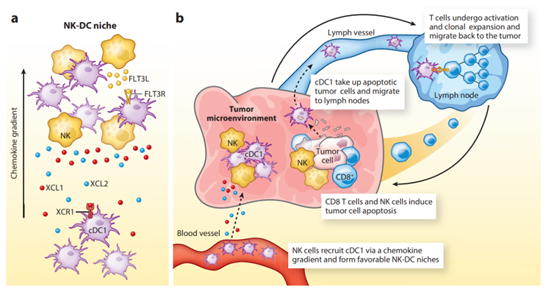
兩項主要研究表明,NK細胞在向腫瘤募集cDC1中起著關鍵作用。第一項研究表明,NK細胞分泌趨化因數,介導cDC1募集到腫瘤中,特別是XCL1、XCL2和CCL5。這是一個重要的發現,因為cDC1選擇性表達XCL1/2的XCR1趨化因數受體。第二項研究側重於FLT3配體,這是一種調節DC分化和存活的關鍵細胞因數。在NK細胞中檢測到這種重要細胞因數的表達。研究顯示, NK細胞(而不是T細胞)的清除大大減少了cDC1向腫瘤的募集。這些研究證明了腫瘤中NK細胞和T細胞反應之間的重要聯繫:NK細胞募集並支援DC的存活,而DC又對T細胞介導的腫瘤免疫至關重要。
靶向T細胞和NK細胞協同作用的免疫治療方法
癌症疫苗
大多數當前的癌症疫苗都關注肽表位,由於個體之間MHC等位基因的巨大多樣性,需要個性化設計。此外,細胞毒性T細胞施加巨大的選擇壓力,導致MHC-I表達下調或缺失的腫瘤克隆出現。一種引發T細胞和NK細胞雙重攻擊的疫苗可以防止MHC-I缺陷型腫瘤克隆的出現,因為MHC-I表達的缺失使腫瘤細胞更容易被NK細胞殺死。人類腫瘤通過活化的MICA和MICB配體在腫瘤細胞上的蛋白水解脫落來逃避活化NKG2D受體的識別。靶向參與蛋白水解脫落的MICA/Bα3結構域的癌症疫苗誘導高滴度抗體,可以抑制脫落並增加腫瘤細胞表面MICA/B蛋白的密度。該疫苗誘導多種T細胞和NK細胞群體顯著歸巢小鼠腫瘤。這種疫苗誘導的抗體在抗腫瘤免疫應答中發揮著重要作用:腫瘤結合的MICA/B抗體增強了DC對CD8+T細胞的腫瘤抗原交叉呈遞,並通過啟動NK細胞上的CD16-Fc受體增加了NK細胞介導的腫瘤細胞殺傷。
靶向抑制性細胞因數
TGF-β是一種主要的免疫抑制細胞因數,可有效抑制腫瘤內的T細胞和NK細胞功能。TGF-β強烈抑制T細胞增殖和效應器功能。在NK細胞中,TGF-β信號抑制mTOR調節的關鍵代謝程式,從而抑制增殖和細胞毒性。TGF-β還抑制腫瘤浸潤NK細胞的多種活化受體的表達,包括NKG2D受體。PGE2在免疫抑制中起著重要作用,也與增強癌細胞存活和侵襲性有關。環氧化酶(COX)-1和2是PGE2合成的關鍵酶,在許多人類癌症中經常過表達。通過Ptgs1和Ptgs2基因的失活抑制小鼠黑色素瘤細胞系中PGE2的合成,導致TME從促腫瘤細胞因數(IL-1β和IL-6)向抗腫瘤的細胞因數/趨化因數(IL-12、IFN-γ和CXCL10)轉變。重要的是,CD103+cDC1在這些Ptgs1/2−/−小鼠的TME中顯著增加,而NK細胞通過分泌XCL1和CCL5在cDC1的募集中發揮核心作用。
工程化刺激性細胞因數
幾種主要的細胞因數同時作用於T細胞和NK細胞,包括IL-2、IL-12、IL-15和IL-18,為增強T細胞和NK細胞功能提供了機會。例如,NKTR-214是一種聚乙二醇形式的IL-2,在一項1期臨床試驗中,NKTR-214單藥治療,26名患者中有14名(53.8%)疾病穩定,迴圈CD4+T細胞、CD8+T細胞和NK細胞大量增殖。同時,IL-15作為治療藥物也在大力開發中,因為它啟動效應T細胞和NK細胞,但不啟動Treg。IL-15對記憶性T細胞的存活很重要,並誘導NK細胞增殖和活化。在一項血液惡性腫瘤復發患者的1期臨床試驗中,IL-15超級激動劑ALT-803在19%的治療患者中誘導了治療反應。與其作用機制一致,ALT-803誘導血液中NK細胞和CD8+T細胞的顯著增殖,並通過迴圈NK細胞增強活化受體(NKG2D、NKp30)和顆粒酶B的表達。
結合T細胞和NK細胞的聯合療法
對在小鼠模型系統中有效治療腫瘤的聯合療法已經確定了四種藥物的組合,簡稱AIPV,其由抗腫瘤抗體(A)、延長半衰期的IL-2(I)、抗PD-1(P)和肽疫苗(V)組成。該方案可以進一步簡化為單劑量AIP(抗腫瘤抗體、IL-2和PD-1抗體)。單劑量AIP治療可誘導快速早期反應,NK細胞和巨噬細胞發揮顯著作用,包括促炎性趨化因數和細胞因數的表達上調。腫瘤結合抗體和延長半衰期的IL-2有助於早期NK細胞活化,這使得能夠招募DC和CD8+T細胞,從而使腫瘤對ICB更敏感。
此外,天然免疫刺激物也提供活化CD8+T細胞和NK細胞的機會。STING激動劑在小鼠模型中誘導由CD8+T細胞和NK細胞介導的強大抗腫瘤反應。STING激動劑通過動員T細胞和NK細胞,與IL-2顯示出強烈的協同作用,以對抗MHC-I缺陷和MHC-I陽性小鼠腫瘤。
最近的研究表明,腫瘤中T細胞的生物學與NK細胞的生物學高度相關。NK細胞在T細胞介導的腫瘤免疫中發揮著重要作用,通過招募DC細胞並支持其生存。儘管NK細胞和T細胞屬於免疫系統的固有和適應性分支,但它們也共用重要的活化和抑制受體配體系統,為免疫治療提供了機會。對人類腫瘤的這些特徵更深入的分子理解可能會發現新的免疫治療靶點,並指導有效參與DC、NK細胞和T細胞的聯合療法的開發。
參考文獻:
1.DesigningCancer Immunotherapies That Engage T Cells and NK Cells. Annu Rev Immunol.2022Nov 29
