全球首款TIL細胞療法完成FDA滾動上市申報
美國生物技術公司Iovance Biotherapeutics近日宣佈,已向FDA完成lifileucel生物製品許可申請(BLA)的滾動式遞交過程。Lifileucel是一種腫瘤浸潤淋巴細胞(TIL)治療方案,用於PD-1/PD-L1治療後進展的晚期黑色素瘤。如果順利獲批,lifileucel將成為全球首款TIL細胞療法。

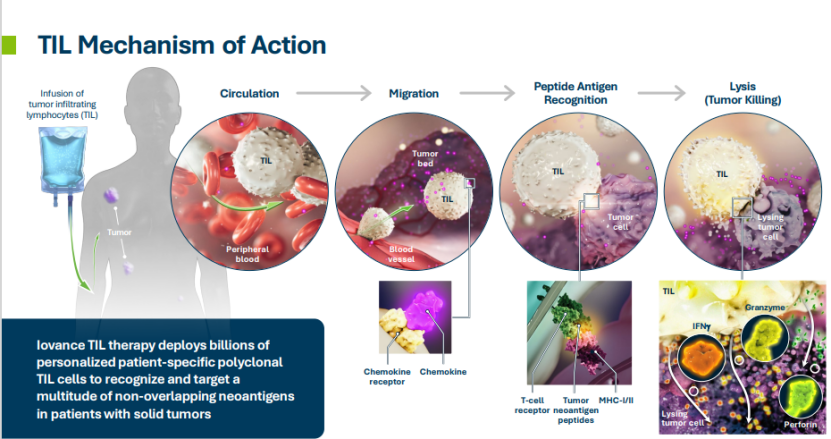
TIL(Tumor Infiltrating Lymphocytes)是腫瘤間質中的異質性淋巴細胞,包括T細胞及NK細胞等。機體在發現體內的癌細胞後,調動免疫細胞深入到腫瘤組織內部,對腫瘤進行識別、抵抗和攻擊。TIL細胞到達腫瘤內部後,通過釋放細胞毒素直接殺傷腫瘤細胞。此外,TIL還能調節機體免疫功能,提高機體對腫瘤細胞的殺傷能力。

與CAR-T細胞療法類似,TIL細胞療法屬於過繼性免疫治療的一種。TIL療法從腫瘤中分離浸潤的淋巴細胞,體外擴增後回輸給患者,由於存在大量患者抗原特異性的TIL細胞,可以特異性識別患者的癌細胞進行殺傷。
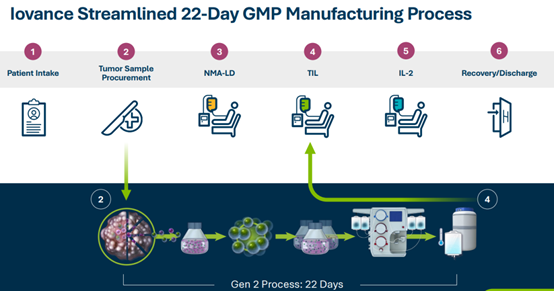
Iovance公司第二代(Gen2)的生產工藝需要22天的製備週期。與此同時,該公司還在探索第3代工藝,有望將製造時間縮短到16天以減少初始腫瘤樣本和患者輸注之間的等待時間。
此次滾動上市申請基於lifileucel治療晚期黑色素瘤患者的II臨床試驗C-144-01的陽性結果。C-144-01研究入組患者為既往接受過包括PD-1抗體在內≥1次全身治療的不可切除或轉移性黑色素瘤;如果患者BRAF V600突變陽性,則採用BRAF抑制劑±MEK抑制劑聯合治療。
該研究共分為4個佇列,其中佇列1(n=30)患者接受非冷凍保存的TIL產品治療;佇列2(n=66)和佇列4(n=75)患者皆接受經冷凍保存的TIL治療;佇列3(n=~10)為重複接受TIL治療患者。
非冷凍保存的TIL產品(Gen1)是一種不通過冷凍保存的腫瘤浸潤淋巴細胞(TIL)療法。Gen1產品通常用於TIL療法開發的早期階段,其中TIL在體外擴增後立即注入患者,因此不需要被冷凍。這與冷凍保存的TIL產品(Gen2)工藝有所不同,後者會被冷凍以備後續使用,以實現長期儲存和運輸。

研究結果顯示,經過獨立影像學委員會(IRC)評估,佇列2的客觀緩解率(ORR)為34.8%;佇列4的ORR為28.7%;佇列2+4的總ORR為31.4%。

Iovance還就lifileucel的III期註冊試驗(研究代號TILVANCE-301)設計方案與FDA達成一致,該試驗是將lifileucel與K藥聯合用於一線晚期黑色素瘤的試驗,不僅旨在全面支持lifileucel獲批用於治療PD-1單抗進展後的黑色素瘤患者,同時也是為了支持lifileucel與K藥聯合用於一線晚期黑色素瘤治療方案的註冊申請。
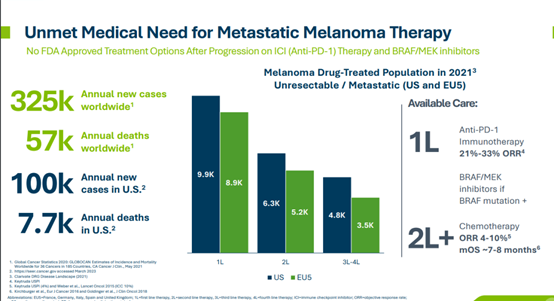
據報導,全球每年約有32.5萬新發黑色素瘤患者,其中每年約有5.7萬患者因該病死亡;美國每年約有10萬人被診斷出患有黑色素瘤,約有7700人死於該疾病。如果獲得FDA的批准,lifileucel將成為一種在晚期黑色素瘤治療中的全新選擇
